题目内容
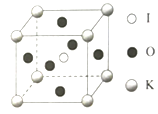
【题目】镁铁水滑石(镁、铁的碱式碳酸盐)是具有层状结构的无机功能材料,可由Mg(NO3)2·6H2O、Fe(NO3)3·9H2O及CO(NH2)2等按一定比例在温度高于90℃时反应制得。
(1)其他条件不变时,n[CO(NH2)2]/n(Fe3+)对镁铁水滑石产率和溶液pH的变化关系如图所示:
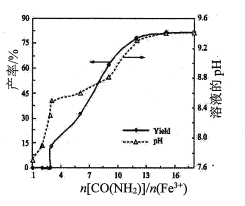
①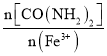 <3,反应液中产生少量气体,测氨仪未检出NH3,说明逸出的气体主要是____________(填化学式)。
<3,反应液中产生少量气体,测氨仪未检出NH3,说明逸出的气体主要是____________(填化学式)。
②n[CO(NH2)2]/n(Fe3+)>12,溶液的pH处于稳定状态,这是因为_________________
(2)镁铁水滑石表示为:[FexMgy(OH)z](CO3)w·pH2O(摩尔质量为660g·mol-1),可通过下列实验和文献数据确定其化学式,步骤如下:
I.取镁铁水滑石3.300g加入足量稀硫酸充分反应,收集到气体112mL(标准状况)。
II.文献查得镁铁水滑石热分解TG-DSC图:303~473K,失去层间水(结晶水)失重为10.9%;473~773K时,CO32-和OH-分解为CO2和H2O;773K以上产物为MgO、Fe2O3。
Ⅲ.称取0.4000g热分解残渣(773K以上)置于碘量瓶中,加入稍过量盐酸使其完全溶解,加入适量水和稍过量的KI溶液,在暗处放置片刻,用0.1000mol·L-1Na2S2O3标准溶液滴定到溶液呈淡黄色,加入3mL淀粉溶液,继续滴定到溶液蓝色消失。(2Na2S2O3+I2=2NaI+Na2S4O6),消耗Na2S2O3溶液20.00mL。通过计算确定镁铁水滑石的化学式______________(写出计算过程)。
【答案】CO2 (达到气液平衡,)溶液中OH-浓度处于(过)饱和状态 [Fe2Mg6(OH)16] CO3·4H2O
【解析】
(1)①根据元素守恒,以及目标产物中含有CO32-,可知如果没有氨气逸出,那逸出的气体主要是CO2;
②从图中可以看出,n[CO(NH2)2]/n(Fe3+)>12时,测氨仪检出的NH3的量也没有变化,从溶液中逸出的NH3的量和溶解在溶液中NH3的相同,达到了平衡状态,溶液中OH-达到饱和状态,答案为:(达到气液平衡,)溶液中OH-浓度处于(过)饱和状态;
(2)Ⅰ镁铁水滑石溶于足量的稀硫酸,其中的CO32-会与H+反应生成CO2,产生112mL的气体,样品的物质的量![]() ,产生CO2的物质的量
,产生CO2的物质的量![]() ,则w=
,则w=![]() ;
;
Ⅱ在303~473K,镁铁水滑石失去结晶水,失重为10.9%,则p=![]() =4;
=4;
Ⅲ由2Fe3++2I-=I2+2Fe2+,2Na2S2O3+I2=2NaI+Na2S4O6,得关系式Fe3+~Na2S2O3,n(Fe3+)=n(Na2S2O3)=0.1000mol·L-1×20.00mL×10-3L·mL-1=2.000×10-3mol,n(Fe2O3)=1.000×10-3mol。热分解残渣中,含有Fe2O3、MgO,则n(MgO)=![]() =6.000×10-3mol;
=6.000×10-3mol;
则镁铁水滑石中镁和铁的比例为![]() =6.000×10-3mol÷2.000×10-3mol=3;
=6.000×10-3mol÷2.000×10-3mol=3;
由化合价代数和为0,x×3+y×2+z×(-1)+1×(-2)=0;
由摩尔质量为660g·mol-1,56g·mol-1×x+24g·mol-1×y+17g·mol-1×z+60g·mol-1×1+18g·mol-1×4=660g·mol-1;
可以解得,x=2y=6z=16,则镁铁水滑石化学式为[Fe2Mg6(OH)16]CO3·4H2O。

 名校课堂系列答案
名校课堂系列答案