题目内容
【题目】补铁剂常用于防治缺铁性贫血,其有效成分一般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是_________(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是_____,碳原子的杂化方式是______;琥珀酸亚铁中存在配位键,在该配位键中配位原子是____,中心原子是____。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:

请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:____。
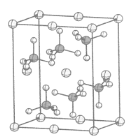
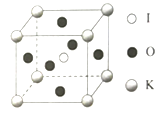
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a= 870 pm、b=680 pm、c=479 pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有____种空间取向,晶胞体内硫酸根离子的个数是____,铁原子周围最近的氧原子的个数为____;设阿伏加德罗常数的值为NA,则该晶体的密度是____ g·cm-3(列出计算表达式)。
【答案】d O sp2、sp3 O Fe 马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此马来酸电离主要以第一步电离为主 2 2 6 ![]()
【解析】
(1)绝大多数过渡元素中,同一元素的价态变化是连续的,因为(n-1)d和ns轨道的能量相差不大,可以逐个失去s电子和d电子造成氧化态的连续变化。基态铁原子核外电子排布式为[Ar]3d64s2,失去4s2变成亚铁离子,由此可得正确答案;
(2)同一周期,随着原子序数的增加,元素的电负性逐渐增大。C、O为同周期元素,H的电负性最小,由此可判断C、H、O的电负性的大小。根据中心原子的孤对电子数以及与中心原子相连的原子个数来判断分子中原子的杂化方式,可分析出丁二酸中C原子的杂化方式。琥珀酸亚铁中O原子有孤电子对,亚铁离子中存在空轨道,根据配合物中中心原子提供空轨道,配位原子必须是含有孤对电子的原子,可以判断出琥珀酸亚铁中配位原子和中心原子。
(3)在马来酸分子中,O原子吸引电子的能力较强,H-O共用电子对偏向O原子,从而提高了羧基的离子性,据此分析。
(4)利用“均摊法”计算晶胞拥有的粒子数目,根据公式xM=ρa3NA求算晶胞的密度。
(1)基态铁原子核外电子排布式为[Ar]3d64s2,失去2个电子后变为亚铁离子,基态亚铁离子核外电子排布式为[Ar]3d6,故能表示能量最低的亚铁离子的电子排布式为d。答案为:d;
(2)H、C、O中H元素的电负性最小,C、O为同周期元素,原子序数越大,电负性越大,因此电负性最大的是O;C原子连接4个原子形成共价键时,C原子采用sp3杂化,C原子连接3个原子形成共价键时,C原子采用sp2杂化。因此丁二酸中C原子的杂化方式为sp2、sp3杂化。丁二酸中只有O原子有孤电子对,亚铁离子中存在空轨道,故琥珀酸亚铁的配位键中配位原子为O原子,中心原子为Fe原子。答案为:O;sp2、sp3;O;Fe;
(3)马来酸存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此一级电离较为容易,而剩余部分因为形成了分子内氢键而很稳定,相对难易电离,因此马来酸电离主要以第一步电离为主。答案为:马来酸中存在分子内氢键,提高了羧基的离子性,有利于酸性电离,因此马来酸电离主要以第一步电离为主;
(4)分析晶胞结构,可知硫酸根离子在空间上的取向有2种: ,β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为
,β-硫酸亚铁的化学式为FeSO4,晶胞中含有亚铁离子数目为![]() ,则晶胞中所含硫酸根离子数目也为4,从晶胞示意图中可以发现有6个硫酸根离子,其中4个位于面上。故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶胞的密度为:
,则晶胞中所含硫酸根离子数目也为4,从晶胞示意图中可以发现有6个硫酸根离子,其中4个位于面上。故晶胞体内有2个硫酸根离子;以体心的亚铁离子为研究对象,每个硫酸根中均有一个氧原子离铁原子最近,亚铁离子周围最近的氧原子的个数为6;该晶胞的密度为: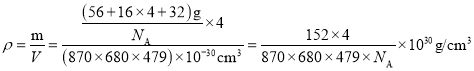 。答案为:2;2;6;
。答案为:2;2;6;![]() 。
。