题目内容
【题目】回答下列问题:
(1)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0,写出该反应的化学平衡常数表达式K=___________。降低温度,二氧化硫的转化率___________(填“增大”“ 减小”“ 不变”)。
2SO3(g) ΔH <0,写出该反应的化学平衡常数表达式K=___________。降低温度,二氧化硫的转化率___________(填“增大”“ 减小”“ 不变”)。
(2)Na2CO3溶液显___________(填“酸性”、“碱性”或“中性”),室温下,pH=10的溶液中,由水电离出的c(OH-)=___________。
【答案】![]() 增大碱性10-4 mol/L
增大碱性10-4 mol/L
【解析】
(1)2SO2(g)+O2(g)2SO3(g),反应的平衡常数K=![]() ;该反应正反应为放热反应,降低温度,平衡正向移动,二氧化硫的转化率增大;
;该反应正反应为放热反应,降低温度,平衡正向移动,二氧化硫的转化率增大;
故答案为:![]() ;增大;
;增大;
(2)Na2CO3属于强碱弱酸盐,水解后溶液显碱性,室温下,pH=10的溶液中,c(H+)=10-10mol/L,则溶液中由水电离出的c(OH-)=![]() =10-4 mol/L,故答案为:碱性;10-4 mol/L。
=10-4 mol/L,故答案为:碱性;10-4 mol/L。

练习册系列答案
相关题目
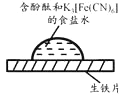
【题目】某同学进行下列实验
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
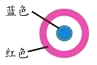
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
C. 边缘处:O2+2H2O+4e-=4OH-
D. 生铁片发生吸氧腐蚀