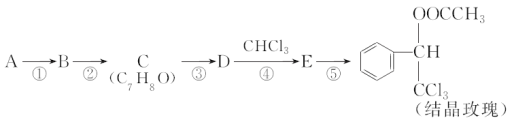
题目内容
【题目】某同学进行下列实验
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
C. 边缘处:O2+2H2O+4e-=4OH-
D. 生铁片发生吸氧腐蚀
【答案】B
【解析】A项,在边缘处,由于铁与氧气和水接触,铁失电子作负极,氧气得电子作正极,发生吸氧腐蚀,说法合理,故A项正确;B项,在交界处与氧气接触,边缘处发生吸氧腐蚀产生的![]() ,与
,与![]() 电离出来的
电离出来的![]() 反应生成
反应生成![]() ,故选项B错误;C项,在边缘处铁与氧气和水接触,发生吸氧反应
,故选项B错误;C项,在边缘处铁与氧气和水接触,发生吸氧反应![]() ,产生的
,产生的![]() 使边缘处溶液显碱性,使酚酞试液变红,即边缘处为红色,故C项正确。D项,在中心区域,由于铁单质与
使边缘处溶液显碱性,使酚酞试液变红,即边缘处为红色,故C项正确。D项,在中心区域,由于铁单质与![]() 电离出来的
电离出来的![]() 反应生成
反应生成![]() ,溶液显蓝色,即中心区域为蓝色,其方程式为
,溶液显蓝色,即中心区域为蓝色,其方程式为![]() ,故D项正确;综上所述,本题正确答案为B。
,故D项正确;综上所述,本题正确答案为B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多