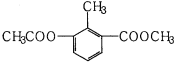
题目内容
【题目】如图所示:若关闭I阀,打开II阀,让氯气经过甲瓶后,再通入乙瓶,布条不褪色;若关闭II阀打开I阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是

①浓H2SO4 ②浓NaOH溶液 ③KI溶液 ④饱和NaCl溶液
A. ② B. ②③ C. ①②③ D. ①②④
【答案】C
【解析】
关闭Ⅰ阀,打开Ⅱ阀,让氯气经过甲瓶后,通入乙瓶,布条不褪色,可知甲中液体可干燥氯气或吸收氯气或与Cl2反应,以此来解答。
关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,可知甲中液体可干燥氯气与吸收氯气,则
①硫酸能干燥氯气,干燥的氯气比具有漂白性,所以乙中不褪色,①符合题意;
②浓氢氧化钠溶液与氯气发生反应,使氯气不能通过甲瓶,②符合题意;
③KI溶液与Cl2反应产生KCl与I2,使氯气不能通过甲瓶,③符合题意;
④饱和氯化钠溶液抑制氯气的溶解,潮湿的氯气通过甲瓶后,可以使湿润的红色布条褪色,④不符合题意;符合题意的是①②③,故合理选项是B。

练习册系列答案
相关题目
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多