题目内容
A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有 种;
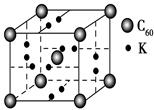
A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为

(2)B的氢化物(H2B)分子的空间构型为 ;在乙醇中的溶解度:s(H2C)>s(H2B),其原因是 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为 (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 键的物质的量为 mol。
键的物质的量为 mol。
(1)在第3周期中,第一电离能大于B的元素有 种;
A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为

(2)B的氢化物(H2B)分子的空间构型为 ;在乙醇中的溶解度:s(H2C)>s(H2B),其原因是 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为 (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有
 键的物质的量为 mol。
键的物质的量为 mol。(1)(4分)3(2分) 4(2分)
(2)(4分)V(折线、角)型(2分) 水分子与乙醇分子之间形成氢键(2分)
(3)(2分)①sp3(1分) ②SiCl4或CCl4(1分)
(4)(2分)16
(2)(4分)V(折线、角)型(2分) 水分子与乙醇分子之间形成氢键(2分)
(3)(2分)①sp3(1分) ②SiCl4或CCl4(1分)
(4)(2分)16
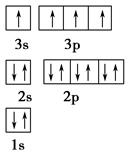
试题分析:A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子,说明A为Zn元素;短周期元素B的一种常见单质为淡黄色粉末,则B元素为S;元素C的原子最外层电子数是其内层电子数的3倍,说明C为O元素。
(1)在第3周期中,第一电离能大于S的元素有P、Cl、Ar 3种元素;S2?位于晶胞的8个顶点和6个面心,根据切割法可得该晶胞实际拥有S2?为:8×1/8+6×1/2=4。
(2)H2S的结构类似于H2O,为V(折线、角)型;乙醇在H2O中的溶解度大于乙醇在H2O中的溶解度,是因为乙醇分子与H2O分子之间能形成氢键,而乙醇分子与H2S分子之间不能形成氢键。
(3)①SO42?为对称结构,即正四面体型,所以S原子轨道的杂化类型是sp3
②与SO42?价电子数和原子数分别相同的微粒有SiCl4或CCl4,为等电子体。
(4)A的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,12个N—H键为
 键,4个N原子与Zn形成的配位键也是
键,4个N原子与Zn形成的配位键也是 键,所以l mol该配合物中含有
键,所以l mol该配合物中含有 键的物质的量为16mol。
键的物质的量为16mol。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。

 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。




 ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。