题目内容
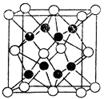
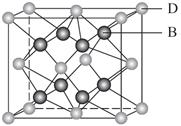
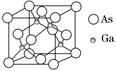
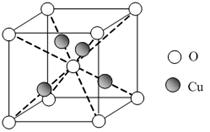
有A、B、C、D、E、F 6种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有3个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“ ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
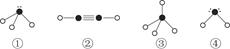
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。

请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“
 ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)平面正三角形
(3)与水分子间形成氢键 H3O+
(4)①③④ 3 2
(5)CaF2
(6)
(2)平面正三角形
(3)与水分子间形成氢键 H3O+
(4)①③④ 3 2
(5)CaF2
(6)

由题意可知,A为氢元素,B为氟元素,C为氮元素,F为硫元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,为铜元素;D是主族元素且与铜元素同周期,并且D与氟元素形成的离子化合物的晶胞中含有8个F原子和8×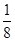 +6×
+6×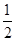 =4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为
=4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为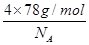 ,则晶胞的体积为
,则晶胞的体积为 。
。
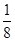 +6×
+6×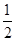 =4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为
=4个D原子,可知其化学式为DF2,D的化合价为+2价,为钙元素。(1)当d轨道全充满或半充满时能量较低,状态较稳定。(2)SO3分子中硫原子形成三个σ键,不含孤电子对,则杂化轨道数为 3,空间构型为平面正三角形。(3)NH3分子和H2O分子可以形成分子间氢键,所以NH3易溶于水;等电子体是原子数相同,价电子数相同的微粒。NH3分子中含有10个电子,与其互为等电子体的阳离子为H3O+。(4)中心原子杂化轨道数=σ键个数+孤电子对数,单键为σ键,双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。由图可知,①所示分子的中心原子中含有3个σ 键和1个孤电子对,杂化轨道数为4,采取sp3杂化,②所示分子的中心原子中含有2个σ 键和0个孤电子对,杂化轨道数为2,采取sp杂化;③所示分子的中心原子中含有4个σ 键和0个孤电子对,杂化轨道数为4,采取sp3杂化;④所示分子的中心原子中含有2个σ 键和2个孤电子对,杂化轨道数为4,采取sp3杂化。(6)根据晶胞结构可以知道一个CaF2晶胞中有4个Ca2+和8个F-,CaF2的摩尔质量为78 g·mol-1,一个晶胞的质量为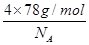 ,则晶胞的体积为
,则晶胞的体积为 。
。
练习册系列答案
相关题目

 键的物质的量为 mol。
键的物质的量为 mol。
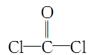 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
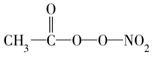 (PAN)等二次污染物。
(PAN)等二次污染物。