��Ŀ����
����Ŀ����2L�����ܱ������У�������Ӧ 2NO��g��+O2��g��2NO2��g���� 
��1��ij�¶�ʱ�������ʵ�����2��1����NO��O2��ʼ��Ӧ��n��NO����ʱ��仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0��4s����O2Ũ�ȱ仯��ʾ�ķ�Ӧ����1��5s����NOŨ�ȱ仯��ʾ�ķ�Ӧ���ʣ�ѡ�С�ڡ��������ڡ��������ڡ�����
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK=����˵���÷�Ӧ�Ѵﵽƽ��״̬���� �� A��������ɫ���ֲ��� B������ƽ����Է����������ֲ���
C�����棨NO��=2������O2��D�������ܶȱ��ֲ���
��3����֪��K300�棾K400�森���д�ʩ��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� ��
A.�����¶�
B.����Arʹѹǿ����
C.����O2ʹѹǿ����
D.ѡ���Ч����
��4����amolNO��bmolO2������Ӧ��Ҫʹ��Ӧ������������ʵ���֮��Ϊ1��2����a/b��ȡֵ��Χ�� ��
���𰸡�
��1������
��2��![]() ��ABC��
��ABC��
��3��C
��4��1�� ![]() ��3
��3
���������⣺��1��0��4s��v��NO��= ![]() =0.00175mol/��L��s��������֮�ȵ��ڻ�ѧ������֮�ȣ���0��4s��v��O2��=
=0.00175mol/��L��s��������֮�ȵ��ڻ�ѧ������֮�ȣ���0��4s��v��O2��= ![]() v��NO��=0.000875mol/��L��s����1��5s��v��NO��=
v��NO��=0.000875mol/��L��s����1��5s��v��NO��= ![]() =0.0005mol/��L��s������0��4s����O2Ũ�ȱ仯��ʾ������Ӧ���ʴ���1��5s����NOŨ�ȱ仯��ʾ������Ӧ���ʣ� ���Դ��ǣ����ڣ���2��2NO��g��+O2��g��2NO2��g����ƽ�ⳣ������ʽK=
=0.0005mol/��L��s������0��4s����O2Ũ�ȱ仯��ʾ������Ӧ���ʴ���1��5s����NOŨ�ȱ仯��ʾ������Ӧ���ʣ� ���Դ��ǣ����ڣ���2��2NO��g��+O2��g��2NO2��g����ƽ�ⳣ������ʽK= ![]() ��A��������ɫ���ٱ仯��˵������������Ũ�Ȳ��䣬��Ӧ����ƽ�⣬��A��ȷ�� B��������������ʼ�ղ��䣬����������ʵ�����ȷ����������ƽ����Է����������ֲ��䣬˵���淴Ӧ���������ڻ���������ʵ������䣬��ʱΪƽ��״̬����B��ȷ��C�����ڦ�����NO��=2������O2������������NO��=2������O2�����������O2��=������O2������Ӧ����ƽ�⣬��C��ȷ��D������������������䣬�����ݻ����䣬�������ܶ�ʼ�ձ��ֲ��䣬��D����ѡ��ABC��
��A��������ɫ���ٱ仯��˵������������Ũ�Ȳ��䣬��Ӧ����ƽ�⣬��A��ȷ�� B��������������ʼ�ղ��䣬����������ʵ�����ȷ����������ƽ����Է����������ֲ��䣬˵���淴Ӧ���������ڻ���������ʵ������䣬��ʱΪƽ��״̬����B��ȷ��C�����ڦ�����NO��=2������O2������������NO��=2������O2�����������O2��=������O2������Ӧ����ƽ�⣬��C��ȷ��D������������������䣬�����ݻ����䣬�������ܶ�ʼ�ձ��ֲ��䣬��D����ѡ��ABC��
���Դ��ǣ� ![]() ��ABC����3��A���ʵ������¶ȣ���Ӧ���ʼӿ죬��K300����K350�� �� ˵�������¶�ƽ�ⳣ����С��ƽ�������ƶ�����A����
��ABC����3��A���ʵ������¶ȣ���Ӧ���ʼӿ죬��K300����K350�� �� ˵�������¶�ƽ�ⳣ����С��ƽ�������ƶ�����A����
B������Arʹѹǿ�������ķ�Ӧ����������Ũ�ȣ���Ӧ���ʲ��䣬ƽ�ⲻ�ƶ�����B����
C������O2��Ũ�ȣ���Ӧ���ʼӿ죬ƽ�������ƶ�����C��ȷ��
D��ѡ���Ч�������ӿ췴Ӧ���ʣ�����Ӱ��ƽ���ƶ�����D����
���Դ��ǣ�C����4������ת��������Ϊxmol����
2NO��g��+ | O2��g�� | 2NO2��g�� | |
��ʼ��mol�� | a | b | 0 |
ת����mol�� | 2x | x | 2x |
ƽ�⣨mol�� | a-2x | b-x | 2x |
��a��2x+b��x����2x=1��2����a+b=4x������x��b�������ɵ� ![]() ��3��������2x��a�������ɵ�
��3��������2x��a�������ɵ� ![]() ��1����1��
��1����1�� ![]() ��3��
��3��
���Դ��ǣ�1�� ![]() ��3��
��3��
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϵ����֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���Ȳ�����ȷ�����⣮

 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ����ʵ����⣮��֪CO��g��+H2O��g��H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���������������ȷ���ǣ� ��
�¶�/�� | 400 | 500 | 830 | 1 000 |
ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
A.�÷�Ӧ������Ӧ�����ȷ�Ӧ
B.�÷�Ӧ�ﵽƽ���������������������¶ȣ�����Ӧ���ʲ��䣬�����ڻ�������ѹǿ����
C.830��ʱ���ں��ݷ�Ӧ���а����ʵ�����n��CO����n��H2O����n��H2����n��CO2��=2��4��6��1Ͷ�뷴Ӧ������������Ӧ����ʼʱ�̦���������
D.830��ʱ����2 L���ܱ������м���4 mol CO��g����6 mol H2O��g���ﵽƽ��ʱ��CO��ת������60%
����Ŀ���Ķ�������Ϣ�� ���Т١���Ϊ������Ԫ����Ҫ���ϼۼ�����⻯��е�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||
�� | �� | �� | �� | �� | �� | |
�⻯��е㣨�棩 | ��33.4 | 100 | 19.54 | ��87.7 | ��60.7 | ��84.9 |
��Ҫ���ϼ� | +5 | ��2 | ��1 | +5 | +6 | +7 |
A��B��C��Ϊ�ϱ��е�Ԫ�أ�
��A��B���γɻ�����AB��AB2 �� ���߿������Ʊ�ǿ��ף�
��C��B���γɻ�����CB2��CB3 �� ���߿������Ʊ�ǿ���ң�
��ش�
��1���ñ�������Ԫ�ص��⻯��������������ͬ���������⻯��֮���ܷ�����Ӧ��д������Ҫ��Ļ�ѧ����ʽ���ж�����ϣ�д������һ�����ɣ���
��2��Ԫ�آ��⻯��ķе����Ԫ�آ��⻯��ķе㣬ԭ���� ��
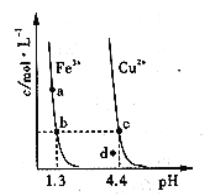
��3���ס��ҷֱ��백��Ӧ���ɱ��������������Σ�0.1mol/L�ļס��ҡ�����������������Һ��pH��С�������е�˳���ǣ���д��ѧʽ�� ��
��4����ϡ�ļ���Һ��Zn��Ӧ������Ӧ�ļ���Zn�����ʵ���֮��Ϊ5��2ʱ����ԭ�������Ϊ����д��ѧʽ���� ��