题目内容
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为 .
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是(用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为 , 1mol As406含有σ键的物质的量为 . 
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是 . 
A.稳定性
B.沸点
C.R﹣H键能
D.分子间作用力
(5)AsH3的沸点(﹣62.5℃)比NH3的沸点(﹣33.5℃)低,原因是
(6)NH4+中的H﹣N﹣H的键角比 NH3中的H﹣N﹣H的键角(填”大”或”小”),原因是
【答案】
(1)1s22s22p63s23p63d104s24p3
(2)N>As>Ga
(3)sp3;12mol
(4)AC
(5)NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;
(6)大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力
【解析】解:(1)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3 , 所以答案是:1s22s22p63s23p63d104s24p3;(2)同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,N原子半径比As和Ga 都小,电负性较大,故这3种元素的电负性由大至小的顺序是N>As>Ga,
所以答案是:N>As>Ga;(3)As4O6的分子中As原子形成3个As﹣O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;1个As406分子中含有σ键数目为12个,故1mol As406含有σ键的物质的量为12mol,
所以答案是:sp3;12mol;(4)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3 , AsH3沸点较高,故B错误;
C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R﹣H键能随原子序数的增大而减小,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;
所以答案是:AC;(5)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
所以答案是:NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;(6)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角大,
所以答案是:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.

【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
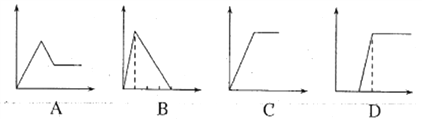
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
【题目】在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)2NO2(g). 
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”).
(2)该反应的平衡常数表达式为K=.能说明该反应已达到平衡状态的是 . A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是 .
A.升高温度
B.充入Ar使压强增大
C.充入O2使压强增大
D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是 .


