��Ŀ����
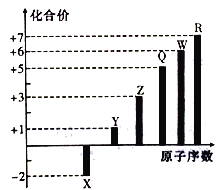
����Ŀ���Ķ�������Ϣ�� ���Т١���Ϊ������Ԫ����Ҫ���ϼۼ�����⻯��е�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||
�� | �� | �� | �� | �� | �� | |
�⻯��е㣨�棩 | ��33.4 | 100 | 19.54 | ��87.7 | ��60.7 | ��84.9 |
��Ҫ���ϼ� | +5 | ��2 | ��1 | +5 | +6 | +7 |
A��B��C��Ϊ�ϱ��е�Ԫ�أ�
��A��B���γɻ�����AB��AB2 �� ���߿������Ʊ�ǿ��ף�
��C��B���γɻ�����CB2��CB3 �� ���߿������Ʊ�ǿ���ң�
��ش�
��1���ñ�������Ԫ�ص��⻯��������������ͬ���������⻯��֮���ܷ�����Ӧ��д������Ҫ��Ļ�ѧ����ʽ���ж�����ϣ�д������һ�����ɣ���
��2��Ԫ�آ��⻯��ķе����Ԫ�آ��⻯��ķе㣬ԭ���� ��
��3���ס��ҷֱ��백��Ӧ���ɱ��������������Σ�0.1mol/L�ļס��ҡ�����������������Һ��pH��С�������е�˳���ǣ���д��ѧʽ�� ��
��4����ϡ�ļ���Һ��Zn��Ӧ������Ӧ�ļ���Zn�����ʵ���֮��Ϊ5��2ʱ����ԭ�������Ϊ����д��ѧʽ���� ��
���𰸡�
��1��NH3+HCl=NH4Cl��
��2��ˮ����֮�������
��3��H2SO4��NH4HSO4��HNO3����NH4��2SO4��NH4NO3
��4��NH4NO3��N2O
���������⣺���Т١���Ϊ������Ԫ����Ҫ���ϼۼ�����⻯��е�����ݣ��٢ܵ���Ҫ���ϼ۶���+5����3������߶��Ǣ�A��Ԫ�أ�Ӧ��ΪN��PԪ�أ��⻯��ΪNH3��PH3 �� ���ڰ�������֮���������������ķе�ϸߣ��ʢ�ΪN����ΪPԪ�أ��ۢ��Щ�1�ۣ����ڵڢ�A�壬����+7�ۣ��Ң۵��⻯��е�ϸߣ��ʢ�ΪFԪ�ء���ΪClԪ�أ���ֻ�Щ�2�ۣ��⻯��е�Ϊ100�棬���ΪOԪ�أ��ݵ���Ҫ���ϼ�Ϊ��2��+6�����ΪSԪ�أ� A��B��C��Ϊ�ϱ��е�Ԫ�أ�
��A��B��Ԫ�ؿ��γɻ�����AB��AB2 �� ��ΪNO��NO2 �� ���߾��������Ʊ�ǿ��ף����Ϊ���ᡢAΪNԪ�أ�
��C��B���γɻ�����CB2��CB3 �� ���߿������Ʊ�ǿ���ң�B��C��Ԫ�ؿ��γɻ�����CB2��CB3�ֱ�ΪΪSO2��SO3 �� ���߾��������Ʊ�ǿ���ң�����Ϊ���ᡢBΪOԪ�ء�CΪSԪ�أ���1������������������ͬ���⻯��֮��ķ�Ӧ����ʽ�У�NH3+HCl=NH4Cl��NH3+H2S=NH4HS��2NH3+H2S=��NH4��2S��N2H4+HF=N2H5F��N2H4+2HF=N2H6F2�ȣ�
���Դ��ǣ�NH3+HCl=NH4Cl�ȣ���2��ˮ����֮�����������������֮����ڷ��»���������ȽϷ��»�����ǿ��������е��ˮ�ͣ�
���Դ��ǣ�ˮ����֮������⣻��3���ס��ҷֱ��백��Ӧ���ɱ��������������Σ�������ΪNH4HSO4����NH4��2SO4��NH4NO3 �� ������Һ�������ԣ�����Խǿ����Һ��pHԽС��H2SO4��NH4HSO4��HNO3����ǿ���ԣ�����Ϊ��Ԫ�ᣬ������Ũ��Ϊ0.2mol/L��������������Ũ��Ϊ0.1mol/L�����������Һ��������������������ĵ����笠����ӵ�ˮ�⣬����Һ��������Ũ�ȴ���0.1mol/L��
��NH4��2SO4��NH4NO3����Һ��笠�����ˮ�����Һ�����ԣ������笠�����Ũ�Ƚϴ�����Һ��������Ũ�ȴ�������泥�
����Ũ�����ʱpH��С�������е�˳���ǣ�H2SO4��NH4HSO4��HNO3����NH4��2SO4��NH4NO3 ��
���Դ��ǣ�H2SO4��NH4HSO4��HNO3����NH4��2SO4��NH4NO3����4������ҺΪ���ᣬ��ϡ��������Һ��Zn��Ӧ������Ӧ��������Zn�����ʵ���֮��Ϊ5��2ʱ����пΪ2mol��������Ϊ5mol����ȫ��Ӧ������2mol����п��ת����4mol���ӣ�
�ٵ�ʣ���1mol������Nԭ����ȫ����ԭʱ����ԭ������N�Ļ��ϼ۱仯Ϊ�� ![]() =4��������N�Ļ��ϼ�Ϊ+5����ԭ������N�Ļ��ϼ�Ϊ5��4=+1���ʻ�ԭ����Ϊ��N2O��
=4��������N�Ļ��ϼ�Ϊ+5����ԭ������N�Ļ��ϼ�Ϊ5��4=+1���ʻ�ԭ����Ϊ��N2O��
�ڵ�ʣ���1mol������Nԭ��ֻ��һ�뱻����ʱ����ԭ������N�Ļ��ϼ۱仯Ϊ�� ![]() =8��������N�Ļ��ϼ�Ϊ+5����ԭ������N�Ļ��ϼ�Ϊ5��8=��3���ʻ�ԭ����ΪNH4NO3 ��
=8��������N�Ļ��ϼ�Ϊ+5����ԭ������N�Ļ��ϼ�Ϊ5��8=��3���ʻ�ԭ����ΪNH4NO3 ��
���Դ��ǣ�NH4NO3��N2O��

����Ŀ����2L�����ܱ������У�������Ӧ 2NO��g��+O2��g��2NO2��g���� 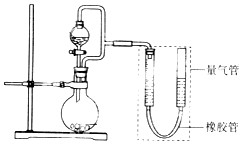
��1��ij�¶�ʱ�������ʵ�����2��1����NO��O2��ʼ��Ӧ��n��NO����ʱ��仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0��4s����O2Ũ�ȱ仯��ʾ�ķ�Ӧ����1��5s����NOŨ�ȱ仯��ʾ�ķ�Ӧ���ʣ�ѡ�С�ڡ��������ڡ��������ڡ�����
��2���÷�Ӧ��ƽ�ⳣ������ʽΪK=����˵���÷�Ӧ�Ѵﵽƽ��״̬���� �� A��������ɫ���ֲ��� B������ƽ����Է����������ֲ���
C�����棨NO��=2������O2��D�������ܶȱ��ֲ���
��3����֪��K300�棾K400�森���д�ʩ��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� ��
A.�����¶�
B.����Arʹѹǿ����
C.����O2ʹѹǿ����
D.ѡ���Ч����
��4����amolNO��bmolO2������Ӧ��Ҫʹ��Ӧ������������ʵ���֮��Ϊ1��2����a/b��ȡֵ��Χ�� ��