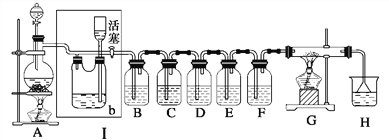
题目内容
【题目】在一定温度下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应: 3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断正确的是( )
A. x=2 B. A的平均反应速率为0.6 mol·L-1·min-1
C. 平衡常数约为0.15 D. 若混合气体的密度不变则表明该反应达到平衡状态
【答案】C
【解析】根据已知条件,可列出平衡功三段式:
3A(g)+B(g) xC(g)+2D(g)
起始浓度(mol/L):1.5 0.5 0 0
转化浓度(mol/L):0.6 0.2 0.2 0.4
平衡浓度(mol/L):0.9 0.3 0.2 0.4
A、浓度变化量之比等于计量系数之比,B和C的浓度变化量相等,则B和C的系数相同,所以x=1,故A错误;B、2min内v(A)= ![]() =0.3mol(Lmin)-1,故B错误;C、平衡常数k=
=0.3mol(Lmin)-1,故B错误;C、平衡常数k=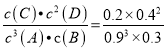 ≈0.15,故C正确;D、由于反应前后气体的质量不变,容器的体积不变,则无论是否达到平衡状态,密度都不变,不能作为平衡状态的判断依据,故D错误。故选C。
≈0.15,故C正确;D、由于反应前后气体的质量不变,容器的体积不变,则无论是否达到平衡状态,密度都不变,不能作为平衡状态的判断依据,故D错误。故选C。

 名校课堂系列答案
名校课堂系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
【题目】在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)2NO2(g). 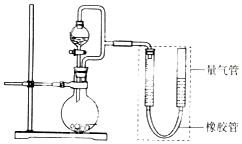
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率1~5s内以NO浓度变化表示的反应速率(选填“小于”、“大于”、“等于”).
(2)该反应的平衡常数表达式为K=.能说明该反应已达到平衡状态的是 . A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是 .
A.升高温度
B.充入Ar使压强增大
C.充入O2使压强增大
D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是 .