题目内容
11.下列有关结构的说法正确的是( )| A. |  是从NaCl晶体结构图中分割出来的部分结构. 是从NaCl晶体结构图中分割出来的部分结构. | |
| B. | 钡在氧气中燃烧得到一种晶体,其结构如图所示,则该晶体的化学式为Ba2O2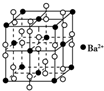 | |
| C. | SiCl4是非极性分子,分子中Si原子处在4个Cl原子所组成的正方形的中心 | |
| D. | 白磷(P4)和甲烷都是正四面体型分子,但分子中的共价键数目和键角均不同 |
分析 A、根据氯化钠晶体中钠离子或氯离子的配位数为6判断其结构图是否正确;
B、根据晶胞的结构可知,黑球表示钡离子,其个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个.阴离子是由2个氧原子构成的,其个数是12×$\frac{1}{4}$+1=4判断;
C、SiCl4中Si与4个Cl形成4个δ键,孤对电子数为0,为正四面体结构;
D、白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心,C-H键键角为白磷键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°.
解答 解:A、由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-,同样每个Cl-周围同时吸引着最近的等距离的6个Na+,故A错误;
B、由晶胞的结构可知,黑球表示钡离子,其个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个.阴离子是由2个氧原子构成的,其个数是12×$\frac{1}{4}$+1=4,所以该晶体的化学式为Ba2O2,故B错误;
C、SiCl4中Si与4个Cl形成4个δ键,孤对电子数为0,为正四面体结构,非极性分子,故C错误;
D、白磷和甲烷都是正四面体结构,白磷共价键数目为6,键角是60°,甲烷共价键数目为4,键角是109°28ˊ,二者共价键数目和键角均不同,故D正确;
故选:D.
点评 本题考查氯化钠晶体结构、分子结构、晶胞结构等,难度不大,需要注意的是P4和CH4都是正四面体型分子但共价键数目和键角均不同.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 含磷洗涤剂造成水污染是因为磷的化合物有毒 | |
| B. | 医用酒精消毒是利用了其使蛋白质变性的性质 | |
| C. | 水泥厂、冶金厂应对工厂烟尘进行处理,以减少对空气的污染 | |
| D. | 福尔马林常用于浸制生物标本 |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等质量的丙烯(C3H6)和环丁烷(C4H8)所含有的原子数一定相等 | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 将5.85g NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA |
6.向100mL 1mol•L-1的NaOH溶液中通入一定量SO2后,将所得溶液蒸干得到5.8g固体物质,则该固体的成分是( )
| A. | Na2SO3 | B. | NaHSO3 | C. | Na2SO3、NaHSO3 | D. | Na2SO3、NaOH |
16. 三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
 三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )| A. | X的结构式为H-Cl-O | B. | X有强氧化性 | ||
| C. | X属于弱酸 | D. | X属于电解质 |
7.下列离子方程式正确的是( )
| A. | 向NaHCO3溶液中加入过量的Ba(OH)2液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Na[Al(OH)4]溶液与NaHCO3溶液混合:[Al(OH)4]-+HCO3-═Al(OH)3↓+CO32-+H2O | |
| C. | 中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| D. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4++2H2O |
4. 称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
 称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )| A. | 试管a溶解过程中温度下降 | |
| B. | 试管b中放入的是NaHCO3固体 | |
| C. | 两试管中水的离子积常数:a<b | |
| D. | 对比液体颜色可知常温下水解程度:CO32->HCO3- |
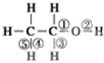 乙醇分子中化学键如图:
乙醇分子中化学键如图: