题目内容
4. 称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )| A. | 试管a溶解过程中温度下降 | |
| B. | 试管b中放入的是NaHCO3固体 | |
| C. | 两试管中水的离子积常数:a<b | |
| D. | 对比液体颜色可知常温下水解程度:CO32->HCO3- |
分析 Na2CO3、NaHCO3都是强碱弱酸盐,都能水解溶液呈碱性,且同浓度的碳酸钠的水解程度大于碳酸氢钠,充分溶解后各滴入2滴酚酞溶液,a、b试管都变红,而且a的红色比b中红色深,说明a的碱性比b的碱性强,所以a是碳酸钠溶液,由此分析解答.
A、含有弱酸根离子的盐溶解中发生水解,而水解过程都是吸热反应;
B、碳酸钠的水解程度大于碳酸氢钠,所以碳酸钠溶液的碱性强于碳酸氢钠,所以红色的试管是碳酸钠;
C、水的离子积常数是温度的函数;
D、a试管颜色深,所以a的碱性强,只有碳酸钠和碳酸氢钠同浓度时比较水解程度.
解答 解:A、含有弱酸根离子的盐溶解中发生水解,而水解过程都是吸热反应,所以两试管温度都下降,故A错误;
B、碳酸钠的水解程度大于碳酸氢钠,所以碳酸钠溶液的碱性强于碳酸氢钠,所以红色的试管是碳酸钠,所以试管b中放入的是NaHCO3固体,故B正确;
C、水的离子积常数是温度的函数,最终温度相同,所以两者水的离子积相等,故C错误;
D、a试管颜色深,所以a的碱性强,而两者的浓度不同,所以无法比较水解程度,故D错误;
故选B.
点评 本题考查碳酸钠和碳酸氢钠的化学性质,侧重于学生的分析能力的考查,为高考常见题型,注意相关基础知识的学习,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
10.下列各组物质熔化所克服的微粒间的作用力属同种类型的是( )
| A. | 石英和生石灰的熔化 | B. | 冰的熔化和氯化钠的熔化 | ||
| C. | 晶体硅和晶体硫的熔化 | D. | 钠和铁的熔化 |
11.下列有关结构的说法正确的是( )
| A. | 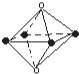 是从NaCl晶体结构图中分割出来的部分结构. 是从NaCl晶体结构图中分割出来的部分结构. | |
| B. | 钡在氧气中燃烧得到一种晶体,其结构如图所示,则该晶体的化学式为Ba2O2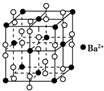 | |
| C. | SiCl4是非极性分子,分子中Si原子处在4个Cl原子所组成的正方形的中心 | |
| D. | 白磷(P4)和甲烷都是正四面体型分子,但分子中的共价键数目和键角均不同 |
12.在强酸性无色溶液中,能大量共存的离子组是( )
| A. | Al3+、MnO4-、SO42-、Cl- | B. | Ba2+、K+、OH-、Cl- | ||
| C. | NH4+、Mg2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CH3COO- |
19.下列变化属于氧化还原反应的是( )
| A. | 馒头在咀嚼过程中产生甜味 | |
| B. | 三氯化铁溶液长期放置产生红褐色固体 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,析出沉淀 | |
| D. | 植物油长期放置发生“酸败产生刺激性气味” |
16.下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | MgBr2的形成过程用电子式表示为: | D. | Cl-的结构示意图 |
13.已知反应2HBr(g)?Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
下列说法正确的是( )
| 实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 从上表数据分析,2HBr?Br2+H2正反应为放热反应 | |
| B. | 实验2中HBr的初始浓度C2=1.0 mol/L | |
| C. | 实验3的反应速率小于实验1的反应速率 | |
| D. | 实验4一定使用了催化剂 |
14.已知:
CH3CH2CH2CH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ/mol
下列说法正确的是( )
CH3CH2CH2CH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ/mol
下列说法正确的是( )
| A. | 正丁烷的稳定性大于异丁烷 | |
| B. | 异丁烷分子中的碳氢键比正丁烷的多 | |
| C. | 等物质的量的正丁烷能量大于异丁烷能量 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
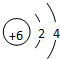 .
.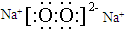 ;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.
;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.