题目内容
2.现有50.0mL某浓度的Na2CO3溶液和30.0mL 1mol/L的盐酸,将该盐酸逐滴滴加到Na2CO3溶液中与将该Na2CO3溶液逐滴滴加到盐酸中产生的气体体积比为2:3,试求Na2CO3溶液的物质的量浓度.分析 将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,若盐酸均足量,生成二氧化碳体积相等,而实际为2:3,故盐酸不足,根据HCl物质的量计算碳酸钠溶液滴入盐酸中生成二氧化碳的物质的量,进而计算盐酸滴入碳酸钠溶液中生成二氧化碳的物质的量,再结合方程式计算.
解答 解:将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,若盐酸均足量,生成二氧化碳体积相等,而实际生成二氧化碳的体积之比为2:3,故盐酸不足,
HCl物质的量为0.03L×1mol/L=0.03mol,故碳酸钠溶液滴入盐酸中生成二氧化碳的物质的量为0.03mol×$\frac{1}{2}$=0.015mol,则盐酸滴入碳酸钠溶液中生成二氧化碳的物质的量为0.015mol×$\frac{2}{3}$=0.01mol,则:
NaHCO3+HCl═NaCl+CO2↑+H2O
0.01mol 0.01mol
Na2CO3+HCl═NaHCO3+NaCl
0.02mol 0.03mol-0.01mol
故Na2CO3溶液的物质的量浓度为$\frac{0.02mol}{0.05L}$=0.4mol/L,
答:Na2CO3溶液的物质的量浓度为0.4mol/L.
点评 本题考查化学方程式有关计算,明确发生的反应判断盐酸不足是解题关键,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
12.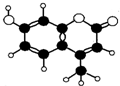 香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3
②能与Br2水发生取代反应
③能与KOH溶液发生反应
④能使酸性KMnO4溶液褪色
⑤1mol香豆素最多能与5molH2反应.
 香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②能与Br2水发生取代反应
③能与KOH溶液发生反应
④能使酸性KMnO4溶液褪色
⑤1mol香豆素最多能与5molH2反应.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③④⑤ |
13.香樟树中可提取一种有机物樟脑(键线式如图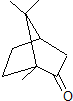 ),下列有关说法正确的是( )
),下列有关说法正确的是( )
 ),下列有关说法正确的是( )
),下列有关说法正确的是( )| A. | 樟脑的分子式为C10H18O | |
| B. | 樟脑中含有2种官能团 | |
| C. | 樟脑在一定条件下可以发生消去反应 | |
| D. | 樟脑有一种特殊的气味,但不属于芳香烃类物质 |
10.下列各组物质熔化所克服的微粒间的作用力属同种类型的是( )
| A. | 石英和生石灰的熔化 | B. | 冰的熔化和氯化钠的熔化 | ||
| C. | 晶体硅和晶体硫的熔化 | D. | 钠和铁的熔化 |
11.下列有关结构的说法正确的是( )
| A. | 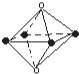 是从NaCl晶体结构图中分割出来的部分结构. 是从NaCl晶体结构图中分割出来的部分结构. | |
| B. | 钡在氧气中燃烧得到一种晶体,其结构如图所示,则该晶体的化学式为Ba2O2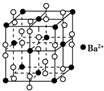 | |
| C. | SiCl4是非极性分子,分子中Si原子处在4个Cl原子所组成的正方形的中心 | |
| D. | 白磷(P4)和甲烷都是正四面体型分子,但分子中的共价键数目和键角均不同 |
16.下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | MgBr2的形成过程用电子式表示为: | D. | Cl-的结构示意图 |