题目内容
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________(填“正”或“逆”)反应方向移动;溶液中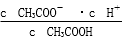 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5 mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L -1H2A溶液稀释到20倍后,溶液的pH=__________。
-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________ 。
。
A.盐酸多 B.H2A多 C .一样多 D.无法确定
.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
练习册系列答案
相关题目


 D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
 确的是
确的是 )
)