题目内容
【题目】某工业残渣主要成分为Fe2O3(含有少量FeO、Cu、Mg等杂质)。某课外兴趣小组利用该残渣制取Fe2O3粉末的流程如下:(说明:流程中“向黄色溶液加入MgO”的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀。)
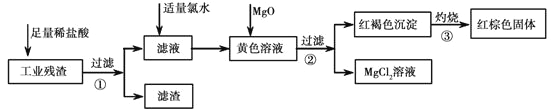
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
A. 氧化还原反应 B.化合反应 C.分解反应 D.复分解反应
(2)加入适量氯水的作用是____________________________.
(3)写出灼烧红褐色沉淀时发生反应的化学方程式_____________________。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。

(4)若向黄色溶液中加入过滤①后的滤渣,发生反应的离子方程式为___________。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中,____________。
【答案】 AD 将Fe2+氧化成Fe3+ 2Fe(OH)3 ![]() Fe2O3+3H2O d 2Fe3++Cu=2Fe2++Cu2+ 滴加KSCN溶液,若溶液变为血红色,说明Fe3+沉淀不完全;若溶液不变色,说明Fe3+沉淀完全
Fe2O3+3H2O d 2Fe3++Cu=2Fe2++Cu2+ 滴加KSCN溶液,若溶液变为血红色,说明Fe3+沉淀不完全;若溶液不变色,说明Fe3+沉淀完全
【解析】本题考查化学工艺流程,(1)工业残渣中加入盐酸,发生Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O、Mg+2H+=Mg2++H2↑,Cu不与盐酸反应,发生的反应类型为置换反应(氧化还原反应)、复分解反应,故选项AD正确;(2)黄色溶液中加入MgO的目的是调节pH,使Fe3+生成沉淀,而Mg2+不沉淀,根据(1)发生反应,因此适量氯水的作用是将Fe2+氧化成Fe3+;(3)红褐色沉淀是Fe(OH)3,Fe(OH)3不稳定受热易分解,因此发生反应是:2Fe(OH)3 ![]() Fe2O3+3H2O;灼烧氢氧化铁沉淀,需要用到坩埚,即选项d正确;(4)黄色溶液含有主要离子是Fe3+、Mg2+、Cl-,操作①中滤渣为Cu,Cu能与Fe3+发生Cu+2Fe3+=2Fe2++Cu2+;(5)需要检验溶液中是否含有Fe3+,具体操作是取过滤②后的少量滤液于试管中,滴加KSCN溶液,若溶液变为血红色,说明Fe3+沉淀不完全;若溶液不变色,说明Fe3+沉淀完全。
Fe2O3+3H2O;灼烧氢氧化铁沉淀,需要用到坩埚,即选项d正确;(4)黄色溶液含有主要离子是Fe3+、Mg2+、Cl-,操作①中滤渣为Cu,Cu能与Fe3+发生Cu+2Fe3+=2Fe2++Cu2+;(5)需要检验溶液中是否含有Fe3+,具体操作是取过滤②后的少量滤液于试管中,滴加KSCN溶液,若溶液变为血红色,说明Fe3+沉淀不完全;若溶液不变色,说明Fe3+沉淀完全。

