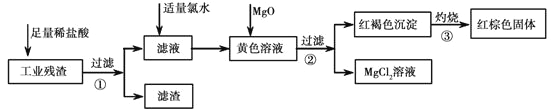
题目内容
【题目】(1)写出下列反应的离子方程式。
①钠和水反应____________________________________。
②硫酸铜溶液中滴加氢氧化钡溶液___________________________________。
(2)3.01×1023个OH-的物质的量为______mol,质量为_______g。
(3)将28g纯净的铁粉投入到200ml足量的稀盐酸中,该反应能够放出标准状况下的气体____L,实验后所得溶液中Fe2+的物质的量浓度为_________mol/L 。
(4)将200 mL 0.5 mol/LNaOH稀释成1000 mL后其物质的量浓度是_________mol/L 。
【答案】 2Na+2H2O=2Na++2OH-+H2↑ Cu2++ SO42-+Ba2++2OH-=BaSO4↓+ Cu(OH)2 ↓ 0.5 8.5 11.2 2.5 0.1
【解析】(1)①钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑;②硫酸铜溶液中滴加氢氧化钡溶液生成硫酸钡和氢氧化铜沉淀,离子方程式为Cu2++ SO42-+Ba2++2OH-=BaSO4↓+ Cu(OH)2↓;(2)3.01×1023个OH-的物质的量为3.01×1023÷6.02×1023/mol=0.5mol,质量为0.5mol×17g/mol=8.5g;(3)28g铁的物质的量是28g÷56g/mol=0.5mol,与盐酸反应失去电子的物质的量是0.5mol×2=1mol,反应中氢元素化合价从+1价降低到0价,所以根据电子得失守恒可知生成氢气的物质的量是1mol÷2=0.5mol,在标准状况下的体积是0.5mol×22.4L/mol=11.2L;根据铁原子守恒可知实验后所得溶液中Fe2+的物质的量浓度为0.5mol÷0.2L=2.5mol/L;(4)根据稀释过程中溶质的物质的量不变可知将200 mL 0.5 mol/LNaOH稀释成1000 mL后其物质的量浓度是![]() 。
。

【题目】控制变量是科学研究的重要方法。向2mLH2O2溶液中滴入2滴1mol/L FeCl3溶液,下列条件下分解速率最快的是
选项 | H2O2溶液的物质的量浓度/ mol·L-1 | 反应的温度/℃ |
A | 1 | 5 |
B | 4 | 5 |
C | 1 | 40 |
D | 4 | 40 |
A. A B. B C. C D. D