题目内容
4.某研究性学习小组进行二氧化硫的制备实验探究.(1)当用过量的铁粉与浓硫酸在加热条件下反应时,发现生成的气体冷却后体积比理论计算所得二氧化硫的体积要多,请你推测可能的原因并说明验证的方法:
①可能原因:随着反应的进行,浓硫酸转化为稀硫酸,稀硫酸与铁反应生成H2,所以生成的气体体积比理论计算所得二氧化硫的体积要多.
②验证方法:将气体通入品红溶液,若红色褪去,说明含有SO2,继续将气体依次通入过量的酸性高锰酸钾、浓硫酸,然后将气体点燃,产物冷却后,若能使无水硫酸铜变蓝,证明此气体为H2.
(2)当用铜与浓硫酸反应制备二氧化硫时发现,铜与热的浓硫酸反应后没有得到预期的蓝色溶液,而是得到白色沉淀.
①请你预测可能的原因:浓硫酸具有吸水性,使水合硫酸铜失水呈白色,或硫酸铜难溶于浓硫酸;
②验证白色沉淀主要成分的方法是将盛有反应物的反应容器中的混合物小心倒入盛有水的烧杯中,边倒边搅拌,可以发现白色沉淀溶解,溶液变蓝色,从而证明其为硫酸铜.
分析 (1)随反应的进行,浓硫酸变为稀硫酸,稀硫酸与Fe反应生成氢气,所以生成气体体积大于理论上生成二氧化硫气体体积;品红溶液检验二氧化硫,检验氢气利用燃烧产物使无水硫酸铜变蓝来说明;
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,以此来分析.
解答 解:(1)①可能原因为:随着反应的进行,硫酸的浓度不断减小,当反应进行一段时间后,浓硫酸转化为稀硫酸,稀硫酸与铁反应不产生SO2,而是产生H2,从反应方程式中可以看出,消耗等量的硫酸,产生H2的体积要多于SO2,
故答案为:随着反应的进行,浓硫酸转化为稀硫酸,稀硫酸与铁反应生成H2,所以生成的气体体积比理论计算所得二氧化硫的体积要多;
②验证方法:将气体通入品红溶液,若红色褪去,说明含有SO2,继续将气体依次通入过量的酸性高锰酸钾、浓硫酸,然后将气体点燃,产物冷却后,若能使无水硫酸铜变蓝,证明此气体为H2,
故答案为:将气体通入品红溶液,若红色褪去,说明含有SO2,继续将气体依次通入过量的酸性高锰酸钾、浓硫酸,然后将气体点燃,产物冷却后,若能使无水硫酸铜变蓝,证明此气体为H2;
(2)①因为硫酸铜粉末为白色,而硫酸铜溶液为蓝色,所以没有得到预期的蓝色溶液,而是得到白色沉淀可能原因:①浓硫酸具有吸水性,使水合硫酸铜失水呈白色②硫酸铜固体难溶于浓硫酸,
故答案为:浓硫酸具有吸水性,使水合硫酸铜失水呈白色,或硫酸铜固体难溶于浓硫酸;
②验证白色沉淀主要成分的方法为:将盛有反应物的反应容器中的混合物小心倒入盛有水的烧杯中,边倒边搅拌,可以发现白色沉淀溶解,溶液变蓝色,从而证明其为硫酸铜,
故答案为:将盛有反应物的反应容器中的混合物小心倒入盛有水的烧杯中,边倒边搅拌,可以发现白色沉淀溶解,溶液变蓝色,从而证明其为硫酸铜.
点评 本题考查浓硫酸的性质,题目难度中等,明确浓硫酸具有强氧化性及发生的化学反应原理为解答本题的关键,试题培养了学生灵活应用基础知识的能力.

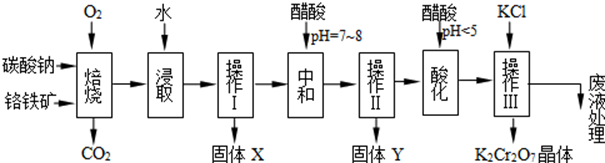
已知1:
①4FeO•Cr2O3+8Na2CO3+7O2 750℃→8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 750℃→2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr207+2KCl=K2Cr207↓+2NaCl,该反应在溶液中能发生的理由是Na2Cr207的溶解度比K2Cr207大
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是:称取n g样品,加入过量NaOH溶液 (写试剂)、溶解、过滤、再通入足量CO2气体…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为26n17m (用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2S203标准溶液滴定,若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)
已知:
①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
I2+2S2O32-=2I-+S4O62-.
| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
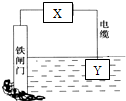
| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: