题目内容
3.常温下,在下列溶液中各组离子一定能够大量共存的是( )| A. | 加入KSCN试液显红色的溶液中:K+、Na+、OH-、Cl- | |
| B. | 加入石蕊试液显蓝色的溶液中:K+、NH4+、NO3-、Cl- | |
| C. | 由水电离的c(H+)═1×10-14mol•L-1的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 向水中通入Cl2达到饱和的溶液中:Al3+、Cu2+、NO3-、SO42- |
分析 A.加入KSCN试液显红色的溶液中含有大量Fe3+,能和铁离子反应的离子不能大量共存;
B.加入石蕊试液显蓝色的溶液呈碱性,和OH-反应的离子不能大量共存;
C.由水电离的c(H+)═1×10-14mol•L-1的溶液呈强酸性或强碱性;
D.向水中通入Cl2达到饱和的溶液中含有大量氯气、次氯酸、盐酸,能和这三种物质反应的离子不能大量共存.
解答 解:A.加入KSCN试液显红色的溶液中含有大量Fe3+,Fe3+和OH-反应生成氢氧化铁沉淀而不能大量共存,故A错误;
B.加入石蕊试液显蓝色的溶液呈碱性,NH4+、OH-反应生成弱电解质一水合氨而不能大量共存,故B错误;
C.由水电离的c(H+)═1×10-14mol•L-1的溶液呈强酸性或强碱性,HCO3-和氢离子、氢氧根离子都反应而不能大量共存,故C错误;
D.向水中通入Cl2达到饱和的溶液中含有大量氯气、次氯酸、盐酸,这几种离子之间不反应且和氯气、次氯酸、盐酸都不反应,所以能大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,明确溶液中离子及其性质是解本题关键,易错选项是C,注意:该溶液呈酸性或碱性.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
13.化学反应速率最主要取决于( )
| A. | 是否使用催化剂 | B. | 反应物的性质 | C. | 反应的温度 | D. | 反应的压强 |
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中正确的是( )
| A. | WX2分子中W原子采取sp3杂化 | |
| B. | WX2是以极性键结合成的非极性分子 | |
| C. | WX2、YX2中的化学键和晶体类型都相同 | |
| D. | 原子半径大小顺序为:X<W<Y<Z |
15.有关如图所示有机化合物的性质说法不正确的是( )
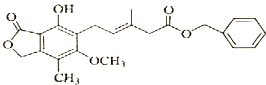

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1 mol 该化合物最多可以与3 mol NaOH反应 | |
| C. | 既能催化加氢,又能使酸性KMnO4溶液褪色 | |
| D. | 既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体 |
12.下列物质、类别、用途或储存方法对应关系都正确的是( )
| 选项 | A | B | C | D |
| 物质 | Na2CO3 | CH3COOH | NH3•HO2 | Na2SiO3 |
| 类别 | 碱 | 弱电解质 | 非电解质 | 强碱弱酸盐 |
| 用途或储存方法 | 氯碱工业产品之一 | 制食醋 | 棕色瓶密封保存 | 带玻璃塞的试剂瓶保存 |
| A. | A | B. | B | C. | C | D. | D |
13.实验室用碳酸钠晶体配制1.00mol•L-1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
| A. | 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时俯视刻度线 | |
| D. | 洗涤液移入容量瓶中时,洒出一部分 |
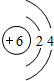 ,D元素在元素周期表中的位置为第四周期第ⅦA族.
,D元素在元素周期表中的位置为第四周期第ⅦA族. ,C、D两元素形成的化合物化学键类型为离子键.
,C、D两元素形成的化合物化学键类型为离子键.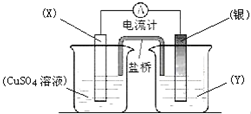 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.