题目内容
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中正确的是( )| A. | WX2分子中W原子采取sp3杂化 | |
| B. | WX2是以极性键结合成的非极性分子 | |
| C. | WX2、YX2中的化学键和晶体类型都相同 | |
| D. | 原子半径大小顺序为:X<W<Y<Z |
分析 短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为硅元素;W与Y同主族,则W为碳元素;W与X可形成共价化合物WX2,X处于第ⅥA族,X与Z分别位于同一主族,故X为氧元素,Z为硫元素.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为硅元素;W与Y同主族,则W为碳元素;W与X可形成共价化合物WX2,X处于第ⅥA族,X与Z分别位于同一主族,故X为氧元素,Z为硫元素.
A.WX2分子为CO2,为直线型结构,分子中C原子采取sp杂化,故A错误;
B.WX2分子为CO2,为直线型结构,分子中正负电荷重心重合,是以极性键结合成的非极性分子,故B正确;
C.CO2和SiO2的均含共价键,其中属于分子晶体,后者属于原子晶体,故C错误;
D.同周期随原子序数越大原子半径越小,故C>O,Si>S,电子层越多原子半径越大S>C,所以原子半径:Si>S>C>O,即X<W<Z<Y,故D错误.
故选:B.
点评 本题考查结构与位置关系、元素周期律、晶体结构等,难度中等,推断元素是关键,注意二氧化硅的晶体结构特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列4组原子序数的元素,彼此间能形成共价键的是( )
| A. | 8和11 | B. | 8和13 | C. | 6和8 | D. | 12和9 |
3.常温下,在下列溶液中各组离子一定能够大量共存的是( )
| A. | 加入KSCN试液显红色的溶液中:K+、Na+、OH-、Cl- | |
| B. | 加入石蕊试液显蓝色的溶液中:K+、NH4+、NO3-、Cl- | |
| C. | 由水电离的c(H+)═1×10-14mol•L-1的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 向水中通入Cl2达到饱和的溶液中:Al3+、Cu2+、NO3-、SO42- |
8.下列变化中需加入还原剂才能实现的是( )
| A. | Cl-→Cl2 | B. | CuO→Cu | C. | Fe2+→Fe3+ | D. | H2SO4→BaSO4 |
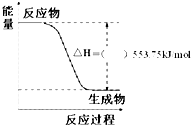 (1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: