题目内容
将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是
| A.两反应中转移的电子数相等 |
| B.消耗NaOH溶液和盐酸的体积不相等 |
| C.消耗铝的质量相等 |
| D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl |
D
涉及反应为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+6HCl=2AlCl3+3H2↑
当两反应产生相同的氢气时,消耗铝的质量相等、两反应中转移的电子数相等、消耗NaOH溶液和盐酸的物质的量比为1:3,得到的NaAlO2与AlCl3的量相等。
反应后两溶液混合:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,可看出AlCl3过量。故答案为D
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+6HCl=2AlCl3+3H2↑
当两反应产生相同的氢气时,消耗铝的质量相等、两反应中转移的电子数相等、消耗NaOH溶液和盐酸的物质的量比为1:3,得到的NaAlO2与AlCl3的量相等。
反应后两溶液混合:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,可看出AlCl3过量。故答案为D

练习册系列答案
相关题目
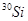 的原子的中子数为_________;
的原子的中子数为_________;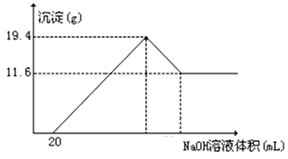
 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况) 过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g