题目内容
11.9gMg、Al、Fe组成的合金溶解于足量的NaOH溶液,合金质量减少2.7g,另取等质量的合金溶解于足量的硝酸中,反应后产生标准状况下的6.72LNO,向所得溶液中加入适量的NaOH溶液恰好使金属离子转化为沉淀,则沉淀为( )g
| A.22.1 | B.27.2 | C.30 | D.14.6 |
B
试题分析:将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量为6.72L/(22.4L/mol)×3=0.9mol,反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,所以反应后沉淀的质量等于11.9g+0.9mol×17g/mol=27.2g,故选B。
点评:本题如果利用化学方程式一步一步计算得话,将会有很大的计算量,所以可以利用最后的电荷守恒来计算,这是解题技巧之一。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ,含有杂质
,含有杂质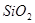 、
、 、
、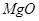 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程:
 生成沉淀F的离子方程式为_______________________。
生成沉淀F的离子方程式为_______________________。