��Ŀ����
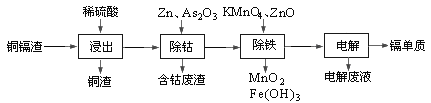
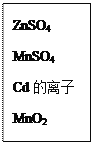
����Ŀ��ʪ����п������ͭ������Ҫ��п��ͭ�������ӣ�Cd�����ܣ�Co���ȵ��ʡ�һ����ͭ�������������ӵ��������£�

�±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ0.1mol/L���㣩��
�������� | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.2 |
������ȫ��pH | 3.3 | 9.9 | 9.5 |
��1�����������У�������ͨ������ķ������н��裬ԭ���Ƿ�ֹ��Cu���������������ӷ���ʽ��__________________��
��2�����ܹ����У�п�ۻ���As2O3�γ���ز���AsH3������ص�������ӦʽΪ_____��
��3������ʱ�ȼ�������KMnO4���ټ���ZnO����pH��
�� ���������У������ϲμӷ�Ӧ������n��KMnO4����n��Fe2+��=_________��
�� ����ʱ����ZnO���Ʒ�ӦҺpH�ķ�ΧΪ________________��
��4��������������Ͷ���KMnO4����������������Һ����FeԪ�ز��ࡣ�����ʵ�鷽��������֤��_____________________��
��5�����������Һ�ö��Ե缫���ɻ���ӵ��ʡ�����Һ�п�ѭ�����õ�������_____��
���𰸡�2Cu+O2+4H+=2Cu2++2H2OAs2O3+12H++12e-=2AsH3+3H2O1��33.3-7.2ȡ������H2O2���ٵ���KSCN��Һ������Һ��죬������Һ�к�FeԪ��H2SO4
���������������������ʪ����п��Ϊ����㣬����������ԭ��Ӧ����ʽ���缫��Ӧ��pH���������������Fe3+���顢���ԭ���ȣ����鿼��ͼ�����Ķ������Ͷ�������ۺϷ������������������Ҫ���������ҵ����������ת����ϵ����������ѡ�ö�Ӧ��֪ʶ�㡣
����������������ת����ϵͼ�·���ǣ�

��1��Cuͨ�����ʱ����������Cu+O2��Cu2+�����ǵ���Һ�����ԣ���ƽ���Ϊ2Cu+O2+4H+=2Cu2++2H2O���𰸣�2Cu+O2+4H+=2Cu2++2H2O��
��2�����ᵽ��ԭ��أ����ý���пһ��ʧȥ��������������õ����ӵ�As2O3�������μӷ�Ӧ����������ӦΪAs2O3+e-��AsH3������ǰһ����������Һ��ȻΪ���ԣ�����ƽ��ΪAs2O3+12H++12e-=2AsH3+3H2O���𰸣�As2O3+12H++12e-=2AsH3+3H2O��
��3�����ڷ�Ӧ����MnO2����KMnO4�õ�������ĿΪ3������������ԭ�����е�ʧ���ӹ�ϵΪ3��n��KMnO4��=1��n��Fe2+����n��KMnO4����n��Fe2+��=1:3��
����ʱ��Fe3+��ȫ����pHΪ3.3��ͬʱ��֤Cd2+���ܳ�����pH���ܳ���7.2�����Ӧ��������Һ��pH����3.3-7.2֮�䡣�𰸣�1:3��3.3-7.2
��4��������Ͷ���KMnO4������ʱ��Fe2+��������֣�pH 3.3-7.2֮�䲻��ʹFe2+��ȫ�������������Һ����Fe2+���࣬��֤�ķ�����Ϊ����Fe2+�������𰸣� ȡ�������Һ����H2O2���ٵ���KSCN��Һ������Һ��죬������Һ�к�FeԪ�� ��
��5�����������Һ�ö��Ե缫���ʱ������Cd2++2e-=Cd������4OH��4e-=2H2O+O2�����ܷ�ӦΪ2CdSO4+2H2O![]() 2Cd+O2��+2H2SO4������Һ�к������ᣬ����ѭ�����á��𰸣�H2SO4
2Cd+O2��+2H2SO4������Һ�к������ᣬ����ѭ�����á��𰸣�H2SO4

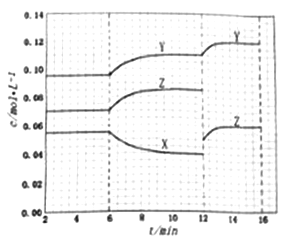
����Ŀ��һ���¶��£���3����ʼ�����Ϊ1.0 L���ܱ������а��±���ʾͶ�ϣ�������ӦN2(g)+3H2(g)![]() 2NH3(g) ��H��0�ﵽƽ�⣬����˵����������
2NH3(g) ��H��0�ﵽƽ�⣬����˵����������
������� | �������� | ��ʼ���ʵ���/mol | ��Ӧ���ת���� | ƽ��ʱNH3�����ʵ���/mol | ||
N2 | H2 | NH3 | ||||
�� | ���º��� | 1 | 3 | 0 | ��1 | 1.2 |
�� | ���Ⱥ��� | 1 | 3 | 0 | ��2 | a |
�� | ���º�ѹ | 2 | 6 | 0 | ��3 | b |
A. �ﵽƽ��ʱ����1>��2
B. ƽ��ʱNH3�����ʵ���b<2.4
C. �ﵽƽ��ʱ���������еķ�Ӧ���ʱ��������еĴ�
D. �����¶Ȳ��䣬�����������ٳ���0.1mol N2��0.2mol H2��0.2 mol NH3��ƽ��������Ӧ�����ƶ�