题目内容
【题目】在某密闭恒容容器中发生反应:X(g) ![]() Y(g)+nZ(g) ΔH=+QkJ/mol(Q>0)。反应体系2min时达到 平衡后,各物质的浓度在不同条件下的变化如下图所示。(第10min到16min的X浓度变化曲线未标出),下列说法不正确的是
Y(g)+nZ(g) ΔH=+QkJ/mol(Q>0)。反应体系2min时达到 平衡后,各物质的浓度在不同条件下的变化如下图所示。(第10min到16min的X浓度变化曲线未标出),下列说法不正确的是
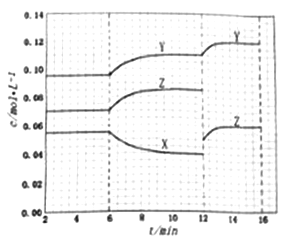
A. 反应方程式中n=1
B. 12min-14min内,用Y表示的评价速率为0.005mol/(L·min)
C. 在6min-10min内,反应吸收的热量为0.015Q kJ
D. 第12min时,Z曲线发生变化的原因是移走一部分Z
【答案】C
【解析】A. 根据图像可知6min~12min时X减少了0.055mol/L-0.040mol/L=0.015mol/L,Z增加了0.085mol/L-0.070mol/L=0.015mol/L,因此反应方程式中n=1,A正确;B. 12min-14min内,用Y表示的评价速率=![]() =0.005mol/(L·min),B正确;C. 在6min-10min内X减少了0.055mol/L-0.040mol/L=0.015mol/L,但容器容积未知。因此不能计算反应吸收的热量,C错误;D. 第12min时Z的浓度瞬间减小,随后逐渐增大,这说明Z曲线发生变化的原因是移走一部分Z,D正确,答案选C。
=0.005mol/(L·min),B正确;C. 在6min-10min内X减少了0.055mol/L-0.040mol/L=0.015mol/L,但容器容积未知。因此不能计算反应吸收的热量,C错误;D. 第12min时Z的浓度瞬间减小,随后逐渐增大,这说明Z曲线发生变化的原因是移走一部分Z,D正确,答案选C。

【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。

