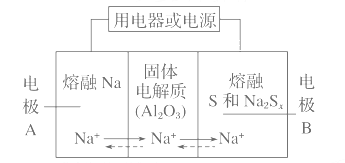
题目内容
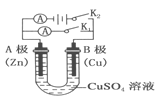
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
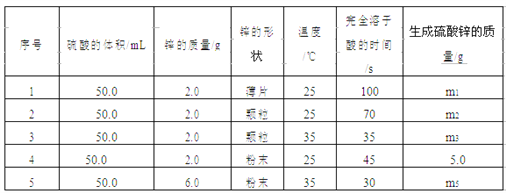
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
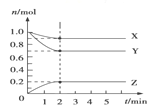
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
【答案】 温度 Zn置换Cu,形成Zn-Cu原电池,加快化学反应速率 0.03 10% X+3Y![]() 2Z C2H5OH-12e-+16OH-=2CO32-+11H2O 减小 Fe Cu或Ag Fe3++e-=Fe2+
2Z C2H5OH-12e-+16OH-=2CO32-+11H2O 减小 Fe Cu或Ag Fe3++e-=Fe2+
【解析】
Ⅰ.(1)实验2和实验3中,除了温度不同外,其它条件完全相同,则说明探究的是温度对反应速率的影响;温度越高,反应速率越快,因此,本题正确答案是:温度。
(2) 若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,因为锌会置换出少量的金属铜,在该条件下构成了原电池,所以反应速率明显加快,因此,本题正确答案是: Zn置换Cu,形成Zn-Cu原电池,加快化学反应速率。
Ⅱ.(3)反应开始至2min时,Y的物质的量减少了![]() ,所以反应速率为:
,所以反应速率为:
![]() ,因此,本题正确答案是:0.03
,因此,本题正确答案是:0.03![]()
![]() 。
。
(4) 反应开始X为1.0mol,至 2 min,X为0.9mol,所以X 的转化率; ![]() = 10%
= 10%
因此,本题正确答案是: 10%。
(5)根据图象可以知道X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且分别是![]() 、
、![]() 、
、![]() ,因为变化量之比是相应的化学计量数之比,所以其系数之比为:
,因为变化量之比是相应的化学计量数之比,所以其系数之比为: ![]() :
:![]() :
:![]() =1:3:2,所以其方程式为:
=1:3:2,所以其方程式为:![]()
![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]()
![]() 。
。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,负极是C2H5OH失电子发生氧化反应,生成的CO2与碱反应变成CO32-,则负极电极反应式为:C2H5OH-12e-+16OH-=2CO32-+11H2O。反应进行后,由于OH-浓度减小,所以溶液的 pH变小,因此,本题正确答案是:减小。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池,因Fe失电子发生氧化反应做负极,正极可以用金属活泼性小于铁的金属或能导电的惰性电极。则负极材料为Fe,正极材料为Cu或Ag等,正极应式Fe3++e-=Fe2+。因此,本题正确答案是: 则负极材料为Fe,正极材料为Cu或Ag,正极反应式为:Fe3++e-=Fe2+。

 阅读快车系列答案
阅读快车系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -25 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→ → →f→g→ → →d→e→j。(填仪器接口字母)_____________
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;__________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置A中导管m的作用是________________。
(4)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为______________。
(5)设计实验证明装置E中收集到的液体中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为__________。