题目内容
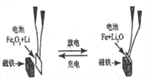
【题目】(1)根据右图回答①②:
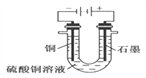
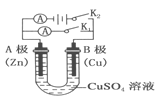
①断开 K2,闭合 K1。B 极的电极反应式为__________。
②断开 K1,闭合 K2。B 极的电极反应式为__________。
(2)根据右图回答③④:
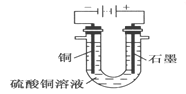
③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解电解反应的离子方程式为___________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
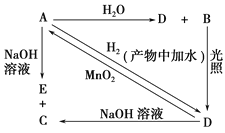
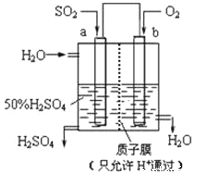
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO),装置如图所示:
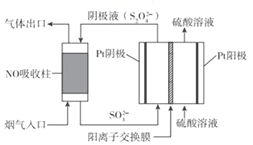
阴极区的电极反应式为_________。
(4)银锌碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (Ag 为+2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池总反应方程式______。
【答案】 Cu2++2e-=Cu Cu-2e-=Cu2+ 2Cu2++2H2O![]() 2Cu+O2+4H+ 0.175a 2SO32-+2e-+4H+=S2O42-+2H2O 2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)4
2Cu+O2+4H+ 0.175a 2SO32-+2e-+4H+=S2O42-+2H2O 2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)4
【解析】
(1)①断开 K2,闭合 K1,此装置为原电池,A做负极失电子,B做正极得电子,所以B 极的电极反应式为Cu2++2e-=Cu。故正确答案为:Cu2++2e-=Cu。
②断开 K1,闭合 K2此装置为电解池,A为电解池阴极得电子,B为电解池阳极失电子。所以B 极的电极反应式为Cu-2e-=Cu2+。故正确答案为:Cu-2e-=Cu2+。
(2)③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解,阳极水中的氢氧根失电子,溶液中铜离子得电子,电解反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2+4H+ 。故本题正确答案为:2Cu2++2H2O
2Cu+O2+4H+ 。故本题正确答案为:2Cu2++2H2O![]() 2Cu+O2+4H+。
2Cu+O2+4H+。
④实验完成后,铜电极增重a g,![]() ,转移
,转移![]() 电子,由可以知道
电子,由可以知道![]() ═
═![]() ,生成
,生成![]() ,
,
则体积为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() 。
。
(3)根据装置图在阴极区里入口进入的是2SO32-,出口出来的物质是S2O42-,根据两种离子中S元素的化合价变化关系,该阴极区的电极反应式为:2SO32-+2e-+4H+=S2O42-+2H2O,所以本题的正确答案为:2SO32-+2e-+4H+=S2O42-+2H2O 。
(4).根据题意,首先写出方程式等号左右两边的反应物和生成物,即反应物有Ag2O2和Zn,生成物有2K2Zn(OH)4和Ag,这四种物质是涉及了化合价升降的物质,先把有化学价升降的元素配平,Ag由+2价变成0价,Zn由0价升到+2价,即Ag和Zn的原子个数要相同,因此可先配平Ag2O2、Zn、KOH、K2Zn(OH)4、Ag这5种物质,然后等式左边会少了氢和氧,那么一般电池中如果少了氢和氧就可以用水来配平,因此,在等式左边加上水再配平。故正确答案为:2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案