��Ŀ����
���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���á�
��1��һ���¶��£���1L�ݻ��㶨���ܱ������г���2 mol N2��8molH2��������Ӧ��10min��ƽ�⣬��ð�����Ũ��Ϊ0��4 mol��L��1����ʱ������ת����Ϊ________��������߰����IJ��ʣ����ݻ�ѧƽ���ƶ�ԭ������������Ľ���______________��д��һ�����ɣ���
��2����ͼ��1mol NO2��g����1mol CO��g����Ӧ����lmol CO2��g����1 mol NO��g�������������仯ʾ��ͼ����д���÷�Ӧ���Ȼ�ѧ����ʽ_____________________��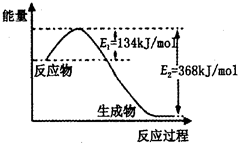
��3�����ݻ��㶨���ܱ������У��������·�Ӧ��N2��g����3H2��g�� 2NH3��g�� ��H��0����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
2NH3��g�� ��H��0����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���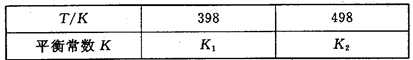
�ٸ÷�Ӧ��ƽ�ⳣ������ʽ��K��_____________��
�����ж�K1__________K2����д��������������������
��NH3��g��ȼ�յķ���ʽΪ��4NH3��g����7O2��g����4NO2��g����6H2O��l������֪��
H2��g����O2��g�� 2H2O��l�� ��H����483��6 kJ��mol
2H2O��l�� ��H����483��6 kJ��mol
N2��g����2O2��g�� 2NO2��g�� ��H����67��8 kJ��mol
2NO2��g�� ��H����67��8 kJ��mol
N2��g����3H2��g�� 2NH3��g�� ��H����92��0 kJ��mol
2NH3��g�� ��H����92��0 kJ��mol
�����NH3��g����ȼ����________kJ��mol��
��1��10%������Ӧ��Ũ�ȣ����¶ȣ�������ѹǿ����ʱת�������ɵİ�������2��NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1��
��3��
�ڣ�����282.8kJ/mol��
���������������1��10min��ƽ�⣬��ð�����Ũ��Ϊ0.4mol/L��������Ũ�ȱ仯��Ϊ0.4mol/L��1/2=0.2mol/L���ʵ�����ת����=0.2/2��100%=10%��
����Ӧ��Ũ�ȣ������¶ȣ�����ѹǿ����ʱת�������ɵİ���������ʹƽ��������Ӧ�����ƶ��������IJ�����ߡ�
��2���÷�Ӧ���ʱ��H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol�������Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1��
��3����N2��g��+3H2��g��?2NH3��g����ƽ�ⳣ������ʽk=
��N2��g��+3H2��g��?2NH3��g����H��0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������K1��K2��
��NH3��g��ȼ�յķ���ʽΪ4NH3��g��+7O2��g���T4NO2��g��+6H2O��l������֪��
��2H2��g��+O2��g���T2H2O��l����H=-483.6kJ/mol
��N2��g��+2O2��g���T2NO2��g����H=+67.8kJ/mol
��N2��g��+3H2��g���T2NH3��g����H=-92.0kJ/mol
���ݸ�˹���ɣ����2-���2+���3�ã�4NH3��g��+7O2��g���T4NO2��g��+6H2O��l������H=2��67.8kJ/mol
-2����-92.0kJ/mol��+3����-483.6kJ/mol��=-1131.2kJ/mol���ʰ�����ȼ����Ϊ1131.2 kJ/mol/4=282.8kJ/mol��
���㣺��ѧƽ����йؼ��㡢��ѧƽ��Ӱ�����ء���ѧƽ�ⳣ������Ӧ�ȵļ����

 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д������Ѿ�����Ӱ�����ǵ����滷�����������糧�ͷų������ĵ������NOx������������Ͷ�����̼���������ɻ�����Ⱦ��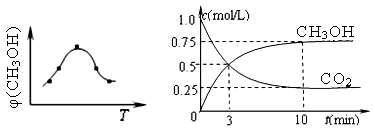
ͼ22-1 ͼ22-2 ͼ22-3
��1�����ü������ԭNOx��
��CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) ��H1=-574kJ?mol-1
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) ��H2=-1160kJ?mol-1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ��H3
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH) �뷴Ӧ�¶�T�Ĺ�ϵ���ߣ���ͼ22-1����������CO2ת��Ϊ�״���Ӧ�ġ�H3 0�����������������=������
����һ���º����ܱ������г���1mol CO2��3mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ22-2��ʾ��
����˵����ȷ���� ������ĸ���ţ���
| A����10min������������ٳ���1molCO2��3molH2�����ٴδﵽƽ��ʱc(CH3OH) ="1.5" mol/L |
| B���ﵽƽ��ʱ��������ת����Ϊ0.75 |
| C��0��10�����ڣ�������ƽ����Ӧ����Ϊ0.075mol/��L?min�� |
| D�����¶��£���Ӧ��ƽ�ⳣ����ֵΪ3/16 |
��3��ij���������н���������������һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʡ��������е�SO2��NO2�����ʵ���֮��Ϊ1��1����÷�Ӧ�Ļ�ѧ����Ϊ ��
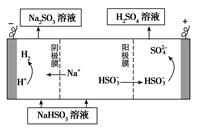
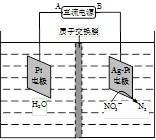
��4���绯ѧ����NO3- ��ԭ������22-3ͼ��ʾ��
�ٵ�Դ����Ϊ (�A����B��)��������ӦʽΪ ��
������������ת����1mol���ӣ���Ĥ������Һ�������仯��(��m������m��)Ϊ g��
��������Ҫ���Եز�����ʣ���������ơ�����þ����̬���ڡ�
��1����֪����Na2SO4(s)=Na2S(s)+2O2(g) �� ��H1=" +1011.0" kJ �� mol-1
��C(s)+O2(g)=CO2(g) �� ��H2=��393.5 kJ �� mol-1
��2C(s)+O2(g)="2CO(g)" ����H3=��221.0 kJ �� mol-1
��Ӧ��Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)����H4= kJ �� mol-1���÷�Ӧ���Է����е�ԭ���� ����ҵ���Ʊ�Na2S���÷�Ӧ�٣����÷�Ӧ�ܵ������� ��
��2����֪��ͬ�¶���2SO2+O2 2SO3��ƽ�ⳣ�����±���
2SO3��ƽ�ⳣ�����±���
| �¶ȣ��棩 | 527 | 758 | 927 |
| ƽ�ⳣ�� | 784 | 1.0 | 0.04 |
1233��ʱ��CaSO4�Ƚ������������Ҫ�ɷ���SO2��O2��������SO3��ԭ���� ��
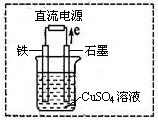
��3������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3����ʱ��Ӧ�Ļ�ѧ����ʽ�� ��
�ڽ�������Ӧ��õ�SO2ͨ�뺬PtCl42-��������Һ���ɻ�ԭ��Pt����Ӧ�����ӷ���ʽ�� ��
����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ���������ĵ缫��ӦʽΪ ��
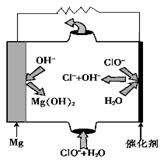
I����֪����Ӧ��H2(g) + Cl2(g) = 2HCl(g) ��H=" ��184" kJ/mol
��4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ��H=" ��115.6" kJ/mol
2Cl2(g)+2H2O(g) ��H=" ��115.6" kJ/mol 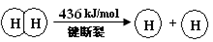
��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ��
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ�� 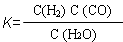 ��������Ӧ�Ļ�ѧ����ʽΪ�� ��
��������Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g)  2NH3(g) ��H<0 ��K="0.5," ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ��������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
2NH3(g) ��H<0 ��K="0.5," ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ��������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g)  2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/K | 300 | 400 | 500 | �� |
| K/(mol��L��1)2 | 4��106 | 8��107 | K1 | �� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<����
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ���
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
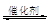 2CO2 (g) +N2 (g)���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
2CO2 (g) +N2 (g)���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
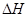 =��867kJ��mol��1
=��867kJ��mol��1 N2O4(g)
N2O4(g) 
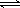 2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
2NH3 ��H ="-92.4" kJ/mol,��ʼ���ǽ�N2��H2�������20mol (�����1��1)����5L�ϳ�����.��ӦǰѹǿΪP0,��Ӧ������ѹǿ��P��ʾ����Ӧ������P/P0��ʱ��t�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
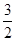 O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1
O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1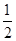 O2(g)=CO2(g)����H����283.0 kJ��mol��1
O2(g)=CO2(g)����H����283.0 kJ��mol��1 CH3OH(g)����H��________kJ��mol��1
CH3OH(g)����H��________kJ��mol��1