题目内容
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是( )
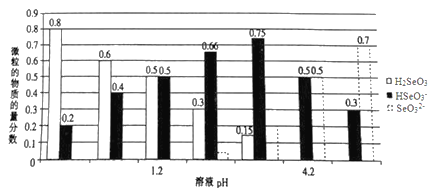
A. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 常温下,亚硒酸的电离平衡常数K2=10-4.2
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
【答案】A
【解析】将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水不能配得pH为4.2的混合液,因为Na2SeO3为强碱弱酸盐,水解显碱性,NaHSeO3水解达到平衡时,pH=4.2,所以两者的混合物的pH大于4.2,A错误;pH=l.2的溶液中H2SeO3和HSeO3-的浓度相等,根据电荷守恒关系:c(Na+)+c(H+)=c(OH-)+c(HSeO3-),可以得到c(Na+)+c(H+)=c(OH-)+c(H2SeO3),B正确;根据电离方程式:H2SeO3![]() HSeO3-+ H+,HSeO3-
HSeO3-+ H+,HSeO3-![]() SeO32-+H+可知,K2=c(H+)c(SeO32-)/c(HSeO3-),当pH=4.2时,达到平衡状态,这时c(SeO32-)= c(HSeO3-),因此K2=10-4.2,C正确; 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,中和了溶液中的氢离子,促进了水的电离,故水的电离程度一直增大,D正确;正确选项A。
SeO32-+H+可知,K2=c(H+)c(SeO32-)/c(HSeO3-),当pH=4.2时,达到平衡状态,这时c(SeO32-)= c(HSeO3-),因此K2=10-4.2,C正确; 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,中和了溶液中的氢离子,促进了水的电离,故水的电离程度一直增大,D正确;正确选项A。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。
