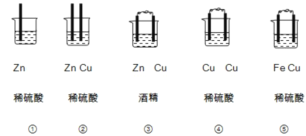
题目内容
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A.该反应过程中的能量变化如图所示
B.该反应条件下,Al的还原性弱于Fe
C.实验室进行该反应时常加入KClO3作催化剂
D.1molFe3O4参与反应转移8×6.02×1023个电子
【答案】D
【解析】
A.铝热反应属于放热反应;
B.氧化还原反应中还原剂的还原性大于还原产物的还原性;
C.铝热反应中氯酸钾受热分解生成氧气;
D.反应中Fe元素的化合价从+8/3价降低到0价。
A. 铝热反应属于放热反应,反应物的总能量大于生成物的总能量,图象不符,故A错误;
B. Al和Fe2O3反应生成Fe和Al2O3,Al作还原剂,Fe是还原产物,所以Al的还原性强于Fe,故B错误;
C. 铝热反应中氯酸钾受热分解生成氧气,反应中KClO3不是催化剂,故C错误;
D. 反应中Fe元素的化合价从![]() 价降低到0价,所以1molFe3O4参与反应转移8×6.02×1023个电子,故D正确;
价降低到0价,所以1molFe3O4参与反应转移8×6.02×1023个电子,故D正确;
故答案选D。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目