题目内容
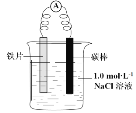
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是____。
②用化学用语解释实验i中的现象:____。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是 __________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a.以上实验表明:在____条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是____________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是 _________。
【答案】碳棒附近溶液变红 O2 + 4e- +2H2O == 4OH- K3Fe(CN)6 可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检测 Cl-存在 Cl-破坏了铁片表面的氧化膜 AC 连好装置一段时间后,取铁片(负极)附近溶液于试管中,滴加K3Fe(CN)6溶液,若出现蓝色沉淀,则说明负极附近溶液中产生Fe2+了,即发生了电化学腐蚀
【解析】
根据图像可知,该装置为原电池装置,铁作负极,失电子生成亚铁离子;C作正极氧气得电子与水反应生成氢氧根离子,正极附近显红色。
要验证K3Fe(CN)6具有氧化性,则需要排除其它氧化剂的干扰,如氧气、铁表面的氧化膜等。
(l)①根据分析可知,若正极附近出现红色,则产生氢氧根离子,显碱性,证明铁发生了电化学腐蚀;
②正极氧气得电子与水反应生成氢氧根离子,电极反应式O2+4e-+2H2O==4OH-;
(2)①K3[Fe(CN)6]具有氧化性,可能氧化Fe为亚铁离子,影响实验结果;
②a对比试验iv和v,溶液中的Na+、SO42-对铁的腐蚀无影响,Cl-使反应加快;
b铁皮酸洗时,破坏了铁表面的氧化膜,与直接用NaCl溶液的现象相同,则Cl-的作用为破坏了铁片表面的氧化膜;
(3)A.实验时酸洗除去氧化膜及氧气的氧化剂已排除干扰,A正确;
B.未排除氧气的干扰,B错误;
C.使用Cl-除去铁表面的氧化膜及氧气的干扰,C正确;
D.加入了盐酸,产生亚铁离子,干扰实验结果,D错误;
答案为AC。
按实验A连接好装置,工作一段时间后,取负极附近的溶液于试管中,用K3[Fe(CN)6]试剂检验,若出现蓝色,则负极附近产生亚铁离子,说明发生了电化学腐蚀。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。