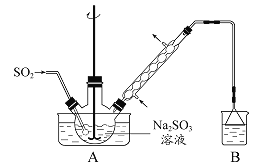
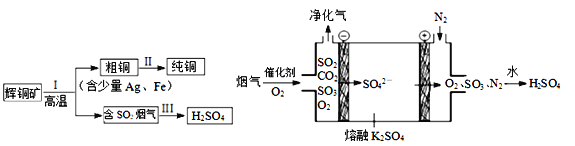
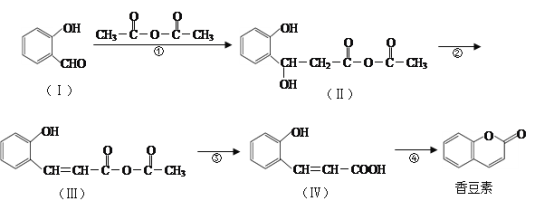
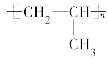题目内容
【题目】甲醇是一种新型的汽车动力燃料。请回答下列问题:
(1)工业上可通过CO和H2化合来制备CH3OH(g)。已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O |
| H-O |
键能/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知:CO中的C与O之间形成的化学键为![]() 键。工业制备甲醇的热化学方程式__________________;
键。工业制备甲醇的热化学方程式__________________;
(2)在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适的催化剂(体积可以忽略不计)后,在250℃下开始反应,并用压力计检测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到20min时,以CO表示的平均反应速率为___________,该温度下平衡常数K= ______;若升高温度,则CO的转化率_______(填“增大”“减小”或“不变”);
(3)在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g) ![]() C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
容器 | 温度/℃ | 起始加入量/mol | 平衡时乙烯/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |
【答案】CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116 kJmol-1 0.0125molL-1min-1 4 减小 < < <
CH3OH(g) ΔH=-116 kJmol-1 0.0125molL-1min-1 4 减小 < < <
【解析】
(1)依据△H=反应物键能总和-生成物键能总和计算ΔH,再写出热化学方程式;
(2)通过(1)写出的热化学方程式可知反应是气体体积减小的放热反应,当反应进行到20min时反应达到平衡状态,依据反应速率概念υ= ![]() 计算速率,平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;结合温度对平衡的影响分析判断;
计算速率,平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;结合温度对平衡的影响分析判断;
(3)根据2CH3OH(g) ![]() C2H4(g)+2H2O(g),A、B起始充入的物质等效,根据容器A、B结合温度对平衡的影响分析判断;容器C中起始时气体的物质的量相当于A的2倍,根据压强对平衡的影响分析判断;根据三段式计算A容器的平衡常数K,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,计算出Qc,根据Qc与K的大小分析判断。
C2H4(g)+2H2O(g),A、B起始充入的物质等效,根据容器A、B结合温度对平衡的影响分析判断;容器C中起始时气体的物质的量相当于A的2倍,根据压强对平衡的影响分析判断;根据三段式计算A容器的平衡常数K,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,计算出Qc,根据Qc与K的大小分析判断。
(1)CO(g)+2H2(g)![]() CH3OH(g),反应的△H=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能,△H═1072kJ/mol+2×436kJ/mol-(3×413kJ/mol +358kJ/mol+ 463kJ/mol) =-116kJmol-1,故答案为:CO(g)+2H2(g)
CH3OH(g),反应的△H=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能,△H═1072kJ/mol+2×436kJ/mol-(3×413kJ/mol +358kJ/mol+ 463kJ/mol) =-116kJmol-1,故答案为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-116 kJmol-1;
CH3OH(g) ΔH=-116 kJmol-1;
(2)从反应开始到20min时,设CO的浓度变化量是x,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
初始浓度(mol/L):0.5 1 0
变化浓度(mol/L): x 2x x
平衡浓度(mol/L):0.5-x 1-2x x
根据反应前后压强之比等于物质的量之比,则![]() =
=![]() ,解得x=0.25mol/L,从反应开始到20min时,以CO表示的平均反应速率υ(CO)=
,解得x=0.25mol/L,从反应开始到20min时,以CO表示的平均反应速率υ(CO)=![]() =
=![]() =0.0125mol/(Lmin);平衡常数K=
=0.0125mol/(Lmin);平衡常数K= =
=![]() =4;该反应为放热反应,温度升高,平衡逆向移动,CO的转化率减小,故答案为:0.0125mol/(Lmin);4;减小;
=4;该反应为放热反应,温度升高,平衡逆向移动,CO的转化率减小,故答案为:0.0125mol/(Lmin);4;减小;
(3)根据2CH3OH(g) ![]() C2H4(g)+2H2O(g),A、B起始充入的物质等效,比较容器A、B可知,升高温度,平衡时乙烯的量减少,说明升高温度平衡逆向移动,因此正反应为放热反应,即△H<0;容器C中起始时气体的物质的量相当于A的2倍,若平衡等效,在体积相同时,平衡压强应该为A的2倍,但增大压强,平衡逆向移动,气体的物质的量减少,因此平衡时容器中总压强p(C)/p(A)<2;对于A容器,
C2H4(g)+2H2O(g),A、B起始充入的物质等效,比较容器A、B可知,升高温度,平衡时乙烯的量减少,说明升高温度平衡逆向移动,因此正反应为放热反应,即△H<0;容器C中起始时气体的物质的量相当于A的2倍,若平衡等效,在体积相同时,平衡压强应该为A的2倍,但增大压强,平衡逆向移动,气体的物质的量减少,因此平衡时容器中总压强p(C)/p(A)<2;对于A容器,
2CH3OH(g) ![]() C2H4(g)+2H2O(g),
C2H4(g)+2H2O(g),
初始浓度(mol/L):0.2 0 0
变化浓度(mol/L):0.1 0.05 0.1
平衡浓度(mol/L):0.1 0.05 0.1
平衡常数K=![]() =0.05,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时Qc=
=0.05,容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时Qc=![]() =0.1>K,平衡逆向移动,说明υ(正)<υ(逆),故答案为:<;<;<。
=0.1>K,平衡逆向移动,说明υ(正)<υ(逆),故答案为:<;<;<。

 互动英语系列答案
互动英语系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。