题目内容
2.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺.某同学在实验室用如图所示装置制备氨气,并测定氨分子中氮、氢原子的个数比.
实验时,先打开开关K,用制得的氨气排尽装置中的空气后再关闭K,并立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
请回答下列问题:
(1)写出用氢氧化镁和氯化铵反应制备氨气的化学方程式:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)装置B和D中的药品相同,你认为是碱石灰(或生石灰或NaOH).
(3)装置E的干燥管中收集到的气体的化学式是N2.
(4)氢氧化镁和氯化铵反应过程中,温度低时固体产物中会混有氢氧化镁杂质,温度高时会混有氧化镁杂质,该同学为测定碱式氯化镁中混有的杂质成分,进行如下操作:准确称取2,914g生成物,加入硝酸至固体完全溶解后,将溶液分成两等份,其中一份用EDTA溶液滴定,测得Mg2+的质量为0.48g,另一份用1.0mol•L-1的AgNO3溶液滴定,消耗AgNO3溶液的体积为18mL,则碱式氯化镁中混有的杂质是MgO(填化学式).
(5)根据上述实验原理,该同学设计了一种实验方案测定氨分子中氮和氢的原子个数比,并列出表达示为$\frac{5V}{7({m}_{1}-{m}_{2})}$,其中m1是反应前氧化铜的质量,V是在标准状况下装置E中测出的气体体积,则m2表示的是氧化铜反应后剩余固体质量.
分析 利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl),用干燥后的氨气还原氧化铜得氮气和水,水被D装置中的碱石灰吸收,用E装置测量产生氮气的体积,根据氧化铜中氧元素的质量等于生成的水中氧元素的质量,进而确定氢元素地质量,根据氮气的体积计算出氮气的物质的量,从而求出氮原子的个数,根据氢、氮的质量比可计算出物质的量之比,进而确定氮、氢原子的个数比,据此答题.
解答 解:利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl),用干燥后的氨气还原氧化铜得氮气和水,水被D装置中的碱石灰吸收,用E装置测量产生氮气的体积,根据氧化铜中氧元素的质量等于生成的水中氧元素的质量,进而确定氢元素地质量,根据氮气的体积计算出氮气的物质的量,从而求出氮原子的个数,根据氢、氮的质量比可计算出物质的量之比,进而确定氮、氢原子的个数比,
(1)根据元素守恒可知,用氢氧化镁和氯化铵反应制备氨气的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O,
故答案为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O;
(2)根据上面分析可知,装置B和D中的药品都是碱石灰(或生石灰或NaOH),
故答案为:碱石灰(或生石灰或NaOH);
(3)根据上面分析可知,装置E的干燥管中收集到的气体是氮气,化学式是N2,
故答案为:N2;
(4)准确称取2.914g生成物,加入硝酸至固体完全溶解后,将溶液分成两等份,其中一份用EDTA溶液滴定,测得Mg2+的质量为0.48g即0.02mol,另一份用1.0mol•L-1的AgNO3溶液滴定,消耗AgNO3溶液的体积为18mL,则Cl-的物质的量为0.018mol,所以在2.914g生成物中含有Mg2+0.04mol,Cl-的物质的量为0.036mol,所以MgOHCl的物质的量为0.036mol,杂质的质量为2.914g-0.036×76.5g=0.16g,其中Mg2+的质量为(0.04-0.036)×24g=0.096g,即0.004mol,则氧元素的物质的量为$\frac{0.16-0.096}{16}$mol=0.004mol,所在在杂质中镁元素与氧元素的物质的量之比为0.004:0.004=1:1,所以杂质为MgO,
故答案为:MgO;
(5)m1是反应前氧化铜的质量,V是在标准状况下装置E中测出的气体体积,设反应后的气阀经铜的质量为x,则氧元素的质量为m1-x,氧元素的物质的量为$\frac{{m}_{1}-x}{16}$,所以氢元素的物质的量为2×$\frac{{m}_{1}-x}{16}$,氮气的物质的量为$\frac{V}{22.4}$,所以氮元素的物质的量为2×$\frac{V}{22.4}$,根据实验原理可知,氨分子中氮和氢的原子个数比为2×$\frac{V}{22.4}$:2×$\frac{{m}_{1}-x}{16}$=$\frac{5V}{7({m}_{1}-x)}$,与$\frac{5V}{7({m}_{1}-{m}_{2})}$比较可知,x即为m2,所以m2表示的是氧化铜反应后剩余固体质量,
故答案为:氧化铜反应后剩余固体质量.
点评 本题考查了测量物质的含量,要求学生具有分析和解决问题的能力,主要是物质探究物质组成和方法的应用,题目难度中等.

| A. | C3H8 | B. | CH4 | C. | C2H6 | D. | C4H10 |
| A. | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,在反应中体现硫酸的还原性 | |
| B. | 向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,反应后有固体剩余,其可能只含铁 | |
| C. | 氢氧化镁和氢氧化铝是常见的阻燃剂,它们分解时发生吸热反应 | |
| D. | 铝在空气中表现为良好的抗腐蚀性,说明铝极难与氧气反应 |
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为akJ | |
| B. | 因CuSO4•5H2O(s)═CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为bkJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于dkJ |
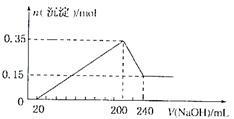 将一定质量Mg和Al的混合物投人500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加人Na0H溶液.生成沉淀的物质的量与加人Na0H溶液体积的关系如图所示.则下列说法正确的是( )
将一定质量Mg和Al的混合物投人500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加人Na0H溶液.生成沉淀的物质的量与加人Na0H溶液体积的关系如图所示.则下列说法正确的是( )| A. | Mg和A1的总质量为8g | |
| B. | 硫酸的物质的量浓度为5mol•L-1 | |
| C. | 生成的H2在标准状况下的体积为11.2L | |
| D. | Na0H溶液的物质的量浓度为5mo1•L-1 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2E<H2D | |
| D. | C单质与浓度相等的稀盐酸反应比A快 |