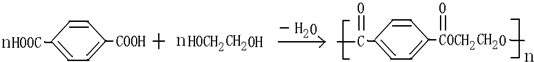题目内容
13.下列有关物质的性质及其解释都正确的是( )| A. | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,在反应中体现硫酸的还原性 | |
| B. | 向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,反应后有固体剩余,其可能只含铁 | |
| C. | 氢氧化镁和氢氧化铝是常见的阻燃剂,它们分解时发生吸热反应 | |
| D. | 铝在空气中表现为良好的抗腐蚀性,说明铝极难与氧气反应 |
分析 A.根据反应前后硫酸中各元素的化合价是否变化判断硫酸的作用;
B.铁的活泼性强于铜;
C.氢氧化镁和氢氧化铝均具有较高的熔点,常做阻燃剂;
D.铝极易与空气的氧气反应生成致密的氧化铝薄膜,阻止了内层铝继续被氧化;
解答 解:A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,是因为氯离子与次氯酸根离子在酸性环境下发生氧化还原反应生成氯气,反应中硫酸中的硫元素化合价不变,不体现硫酸的还原性,故A错误;
B.向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,稀硫酸与铁反应生成硫酸亚铁和氢气,与氧化铁反应生成硫酸铁和水,铁与三价铁离子反应生成二价铁离子,铜与三价铁离子反应生成铜离子和二价铁离子,因为铁的活泼性强于铜,若反应后有固体剩余,则剩余固体可能为铜,或者铜与铁的混合物,故B错误;
C.氢氧化镁和氢氧化铝均具有较高的熔点,常做阻燃剂,大多数物质的分解反应都是吸热的,故C正确;
D.铝属于活泼金属,极易与空气的氧气反应生成致密的氧化铝薄膜,阻止了内层铝继续被氧化,故表现出抗腐蚀性,故D错误;
故选:C.
点评 本题考查了元素化合物知识,涉及漂白粉、铁及其化合物、氢氧化铝、氢氧化镁、铝的性质,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
相关题目
3.下列关乙醇的性质中,不正确的是( )
| A. | 乙醇可以与钠作用生成氢气 | B. | 乙醇可以被氧化为乙醛 | ||
| C. | 乙醇与乙烷互为同分异构体 | D. | 乙醇有挥发性 |
4.石油炼制过程中,既能提高汽油产量又能提高汽油质量的方法是( )
| A. | 蒸馏 | B. | 分馏 | C. | 裂解 | D. | 裂化 |
8.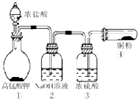 高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )
高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )
 高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )
高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )| A. | ①处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
5.某溶液中只可能含有下列离子的几种:Na+、NH4+、Ba2+、SO42-、I-、CO32-为了确定该溶液中的离子种类,某学生已做了以下两个实验:①取样,用pH计测试,溶液显弱酸性;②另取样,加氯水和淀粉无明显现象.还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
3.下列溶液中,溶质的物质的量浓度最大的是( )
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |