题目内容
【题目】有资料显示过量的 NH3 和 Cl2 在常温下可合成岩脑砂(主要成分为 NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
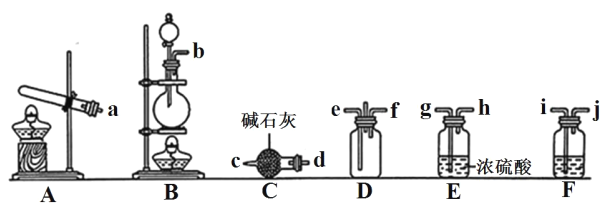
①利用装置 A 制取实验所需的 NH3,写出反应的化学方程式:_______。
②已知该实验中用浓盐酸与 MnO2 反应制取所需 Cl2,装罝 F中的试剂是饱和食盐水,则 F装置的作用是_______。
③为了使NH3和Cl2在D中充分混合,请确定上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明NH3和Cl2反应有岩脑砂生成,需要用到的实验用品中除了蒸馏水、稀 HNO3、 红色石蕊试纸外,还需要用到的试剂有_______。(填试剂的化学式)
(2)岩脑砂中元素的测定
准确称取 a g 岩脑砂,与足量的氧化铜混合加热,利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。(已知该过程发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
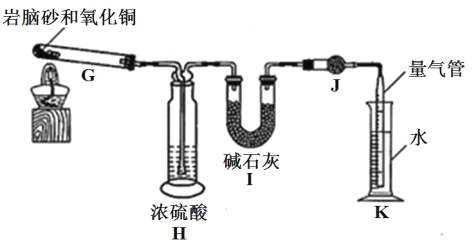
⑤设置装置 H 的目的是______。
⑥若装置 I 增重 b g,利用装置 K 测得气体体积为 V L(已知常温常压下的气体摩尔体积为 24.5L·mol-1),则岩脑砂中 n(N):n(Cl)= ______(用含 b、V的代数式表示,不必化简)。
⑦若测量体积时气体温度高于常温(其他操作均正确),则 n(N)比正常值______ (填“偏高”“偏低”或“无影响”)。
【答案】 2 NH4Cl + Ca(OH)2 ![]() CaCl2 + 2 NH3↑ + 2H2O 除去 Cl2 中的 HCl 气体 a→d c ;h g←j i←b AgNO3、 NaOH 吸收混合气体中的水蒸气,防止对测定 HCl 的质量产生影响
CaCl2 + 2 NH3↑ + 2H2O 除去 Cl2 中的 HCl 气体 a→d c ;h g←j i←b AgNO3、 NaOH 吸收混合气体中的水蒸气,防止对测定 HCl 的质量产生影响 ![]() :
:![]() 偏高
偏高
【解析】(1) ①依据实验室制备氨气的原理分析;②依据实验室制备干燥氯气原理分析;③根据氨气和氯气的密度不同分析;④根据NH4+和Cl-的检验方法分析。
(2) 实验中G处产生的气体有N2、HCl、H2O(g),气体通过浓硫酸除去H2O(g),再通过碱石灰时只有HCl气体被吸收,余下的N2可以在量气管中测出气体体积。⑤H的目的是吸收混合气体中的水蒸气。⑥若装置 I 增重 b g为HCl,n(HCl)=![]() ,K 测得N2:n(N2)=
,K 测得N2:n(N2)= ![]() ,⑦气体测量时气体温度偏高直接导致V偏大,所以n(N)偏高。
,⑦气体测量时气体温度偏高直接导致V偏大,所以n(N)偏高。
(1) ①A装置适用于固体加热制备气体,所以制取NH3时一般选用NH4Cl和Ca(OH)2,反应原理:2 NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O 。
CaCl2 + 2NH3↑ + 2H2O 。
②实验室用浓盐酸与 MnO2 反应制取Cl2可在B装置中进行,生成的氯气含有水蒸气和氯化氢气体,可以选用F除去氯化氢气体,再用E除去水蒸气,所以F中盛放饱和食盐水。
③制取氯气的气流流向为b i j gh,制取氨气的气流流向为ad c,考虑到氨气密度小于空气而氯气密度大于空气,所以氨气从e口进,氯气从f口进,氨气和氯气会形成逆向流动,更有利于二者充分混合,同时要注意确定连接顺序时,氯气气流是从右向左的,合理连接顺序:a→d c→e f←h g←j i←b。④检验固体氯化铵中的铵根离子,需要氢氧化钠溶液和 红色石蕊试纸,固体中检验Cl-需要水、稀硝酸和硝酸银溶液,缺少的是AgNO3、 NaOH。
(2) 实验中G处产生的气体有N2、HCl、H2O(g),气体通过浓硫酸除去H2O(g),再通过碱石灰时只有HCl气体被吸收,余下的N2可以在量气管中测出气体体积。
⑤H 的目的是吸收混合气体中的水蒸气,防止对测定 HCl 的质量产生影响。
⑥若装置 I 增重 b g为HCl,n(HCl)=![]() ,K 测得N2:n(N2)=
,K 测得N2:n(N2)= ![]() ,所以 n(N):n(Cl)=
,所以 n(N):n(Cl)= ![]() :
:![]() 。故答案为:
。故答案为:![]() :
:![]()
⑦气体测量时气体温度偏高直接导致V偏大,所以n(N)偏高。故答案为:偏高。

【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)用电子式表示HCl的形成过程_____________________________。
(2)依据上表,可以推测出:随着原子序数的递增,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(3)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________________________________。
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:
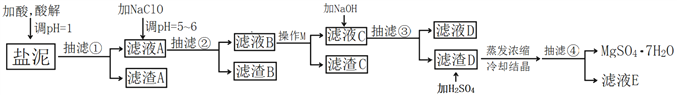
已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)

根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。