题目内容
10.保护环境、合理利用资源已成为人类共同的目标.请判断下列说法是否正确(填“对”或“错”).(1)含磷洗涤剂会导致水体污染.对
(2)二氧化碳会导致酸雨形成.错
(3)氮氧化物会导致光化学烟雾.对
(4)垃圾资源化符合可持续发展.对.
分析 (1)含磷洗衣粉会导致水体富营养化,引起水华、赤潮;
(2)酸雨是由氮的氧化物与二氧化硫的排放引起,与二氧化碳排放无关;
(3)氮氧化物与光化学烟雾有关;
(4)垃圾分类并回收利用可以减少污染,节约能源.
解答 解:(1)含磷洗衣粉会导致水体富营养化,导致水体污染,故答案为:对;
(2)二氧化碳不会导致酸雨形成,故答案为:错;
(3)氮氧化物与光化学烟雾有关,是导致光化学烟雾的主要物质,故答案为:对;
(4)垃圾分类并回收利用可以减少污染,节约能源,符合可持续发展理念,故答案为:对.
点评 本题考查了化学与环境污染的防止,熟悉生活中常见环境污染,养成绿色环保、节能减排的习惯,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
20.关于CO2说法正确的是( )
| A. | 碳原子采取sp1杂化 | B. | CO2是正四面体型结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
1.下列说法正确的是( )
| A. | F、Cl、Br、I最高价氧化物对应水化物的酸性依次减弱 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素原子的最外层电子数等于元素的最高化合价 | |
| D. | Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |
5.在图所示的原电池中,下列说法正确的是( )
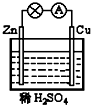

| A. | 正极反应为 Cu-2e-Cu2+ | B. | 溶液中H+向锌片移动 | ||
| C. | 电子由锌片通过导线流向铜 | D. | 该装置能将电能转化为化学能 |
2.X、Y、Z、R为四种同一周期的非金属元素,它们的最高价氧化物对应的水化物中,酸性最弱的是( )
| A. | H2XO3 | B. | H2YO4 | C. | HZO4 | D. | H3RO4 |
19.向溴水、溴的四氯化碳溶液中分别通入丙烯,下列判断正确的是( )
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
20.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)写出生产过程中XFe YHCl(填化学式).
(2)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低原因是pH较大时,Cu2+水解程度增大,反应生成CuCl减少.
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液250mL于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)写出生产过程中XFe YHCl(填化学式).
(2)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液250mL于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
 .
.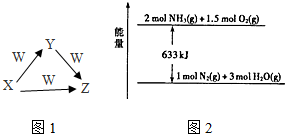 X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白.
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白. 3CO2+2Fe.(用化学方程式表示)
3CO2+2Fe.(用化学方程式表示)