题目内容
2.下列对Be及其化合物的叙述中,正确的是( )| A. | Be的原子半径小于B 的原子半径 | |
| B. | Be比Na金属性强 | |
| C. | Be的最高价氧化物对应水化物碱性弱于Ca(OH)2 | |
| D. | Be能跟冷水反应产生氢气 |
分析 A.同周期自左而右原子半径减小;
B.同主族自上而下金属性增强,同周期自左而右金属性减弱;
C.金属性越强,最高价氧化物对应水化物的碱性越强;
D.金属性越强,与水反应也容易,结合Mg与水反应判断.
解答 解:A.Be、B同周期,自左而右原子半径减小,故原子半径Be>B,故A错误;
B.同主族自上而下金属性增强,同周期自左而右金属性减弱,故金属性Na>Be,故B错误;
C.金属性Be<Ca,金属性越强,最高价氧化物对应水化物的碱性越强,即碱性:Be(OH)2<Ca(OH)2,故C正确;
D.同主族自上而下金属性增强,故金属性Be<Mg,金属性越强,与水反应也容易,Mg与冷水发生微弱反应,故Be能跟冷水不反应,故D错误,
故选:C.
点评 本题考查元素周期律知识,比较基础,注意同主族元素性质的相似性与递变性.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
5.将Na、Mg、Al各0.3mol,分别放入100mL 2mol•L-1的盐酸中,同温同压下产生的气体的体积比是( )
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:2:2 | D. | 3:1:1 |
7.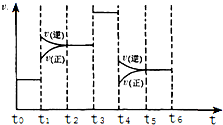 如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
根据上述元素回答问题:(本题用化学用语回答)
(1)上述元素中地壳中极为丰富的元素O,单质中熔点最高的可能是C,E、F、G离子半径由小到大的顺序是Na+<F-<Cl-,写出化合物A2D2的电子式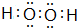 ;
;
(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(3)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是t0~t1.温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为0.05mol/(L﹒s).
 如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.| A | |||||||
| B | C | D | E | ||||
| F | G | H | |||||
(1)上述元素中地壳中极为丰富的元素O,单质中熔点最高的可能是C,E、F、G离子半径由小到大的顺序是Na+<F-<Cl-,写出化合物A2D2的电子式
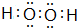 ;
;(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(3)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是t0~t1.温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为0.05mol/(L﹒s).
14.如表是元素周期表的一部分,针对①-⑧元素,填写下列空白.
(1)①的最简单气态氢化物分子的空间构型为正四面体结构.
(2)②的气态氢化物稳定性比⑦的气态氢化物强.(填“强”、“弱”或“相同”)
(3)由③与⑦形成的化合物的电子式为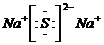 ,①的最高价氧化物的电子式为
,①的最高价氧化物的电子式为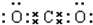 .
.
(4)④、⑥、⑧原子半径依次减小(填“增大”、“减小”或“不变”),②、⑤、⑦形成的简单离子半径由大到小顺序为(填离子符号)S2->F->Al3+.
(5)⑥的原子结构示意图为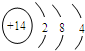 ,其最高价氧化物形成的晶体类型为原子晶体.
,其最高价氧化物形成的晶体类型为原子晶体.
(6)⑤的最高价氧化物对应水化物与③的最高价氧化物对应水化物溶液反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②的气态氢化物稳定性比⑦的气态氢化物强.(填“强”、“弱”或“相同”)
(3)由③与⑦形成的化合物的电子式为
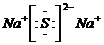 ,①的最高价氧化物的电子式为
,①的最高价氧化物的电子式为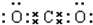 .
.(4)④、⑥、⑧原子半径依次减小(填“增大”、“减小”或“不变”),②、⑤、⑦形成的简单离子半径由大到小顺序为(填离子符号)S2->F->Al3+.
(5)⑥的原子结构示意图为
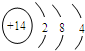 ,其最高价氧化物形成的晶体类型为原子晶体.
,其最高价氧化物形成的晶体类型为原子晶体.(6)⑤的最高价氧化物对应水化物与③的最高价氧化物对应水化物溶液反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
11.下列关于物质分类的说法正确的是( )
| A. | 液氯、金刚石都属于单质 | B. | 漂白粉、CuSO4•5H2O都属于混合物 | ||
| C. | 次氯酸、氨气都属于电解质 | D. | 蛋白质、油脂都属于高分子化合物 |
12.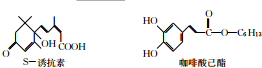 S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )
S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )
 S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )
S-诱抗素是植物生长的平衡因子,咖啡酸乙酯具有抗肿瘤活性动,两者的结构如图所示.下列说法中不正确的是( )| A. | S-诱抗素核磁共振氢谱图中有11组峰 | |
| B. | 咖啡酸乙脂能使酸性KMnO4溶液褪色 | |
| C. | 两者都不能与金属钠反应放出氢气 | |
| D. | 两者互为同分异构体 |
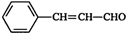 ;
;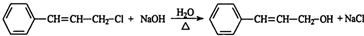 ;
;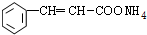 +2Ag+3NH3+H2O;
+2Ag+3NH3+H2O;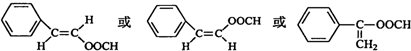 .
.