题目内容
11.下列关于物质分类的说法正确的是( )| A. | 液氯、金刚石都属于单质 | B. | 漂白粉、CuSO4•5H2O都属于混合物 | ||
| C. | 次氯酸、氨气都属于电解质 | D. | 蛋白质、油脂都属于高分子化合物 |
分析 A.由一种元素组成的纯净物是单质;
B.由一种物质组成的为纯净物;
C.在水溶液中或熔融状态下均不能导电的化合物属于非电解质;
D.相对分子质量很大的化合物是高分子化合物,常见的天然有机高分子化合物有蛋白质、纤维素和淀粉.
解答 解:A.由一种元素组成的纯净物是单质,金刚石、液氯都是由一种元素组成的纯净物,所以属于单质,故A正确;
B.由一种物质组成的为纯净物,漂白粉的主要成分是氯化钙、次氯酸钙,所以为混合物,故B错误;
C.氨气不能电离出自由移动的离子,属于非电解质,故C错误;
D.相对分子质量很大的化合物是高分子化合物,常见的天然有机高分子化合物有蛋白质、纤维素和淀粉,油脂是小分子有机物,故D错误.
故选A.
点评 本题考查了基本概念,明确单质、纯净物、电解质、高分子化合物的概念是解本题关键,知道常见物质的成分结合基本概念即可解答,题目难度不大.

练习册系列答案
相关题目
14.对下列各组物质关系的描述中不正确的是( )
| A. | O2和O3互为同素异形体 | B. | 1H、2H和3H互为同位素 | ||
| C. | CH2═CH2和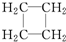 互为同系物 互为同系物 | D. | 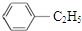 和 和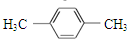 互为同分异构体 互为同分异构体 |
2.下列对Be及其化合物的叙述中,正确的是( )
| A. | Be的原子半径小于B 的原子半径 | |
| B. | Be比Na金属性强 | |
| C. | Be的最高价氧化物对应水化物碱性弱于Ca(OH)2 | |
| D. | Be能跟冷水反应产生氢气 |
19.在反应:C(s)+CO2(g)?2CO(g)中,可使反应速率增大的措施是( )
①缩小体积增大压强②降低温度③增大CO浓度④增加碳的量.
①缩小体积增大压强②降低温度③增大CO浓度④增加碳的量.
| A. | ①②③ | B. | ①③ | C. | ①②③④ | D. | ③④ |
6.元素周期律(表)是认识元素化合物性质的重要理论.
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.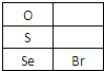
①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是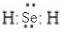 .
.
③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.

①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是
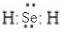 .
.③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O═Se+2H2SO4 |
| 2 | 还原性 | SeO2+2H2O2=H2SeO4+2H2O |
| 3 | 酸性氧化物 | SeO2+NaOH=Na2SeO3+H2O |
16.下列有关化学用语的表示正确的是( )
| A. | 质子数为17,中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 硫离子的结构示意图: | |
| C. | 甲烷分子的比例模型: | |
| D. | 氯乙烯分子的结构简式:CH2-CH2Cl |
3.原子序数依次增大的四种短周期元素X、Y、Z、W,其中Y、Z、W同周期,X和W同主族,简单离子半径的大小为X->Y+,其中Z为地壳中含量最高的金属元素,则下列说法正确的是( )
| A. | X和W元素的最高正价相同 | |
| B. | Y、Z均为金属元素,故X、Y、Z三种元素不能形成化合物 | |
| C. | 工业上常利用电解ZW3溶液冶炼金属Z | |
| D. | Y、W的最高价氧化物水化物均能溶解Z单质 |
20.下列实验现象描述正确的是( )
| A. | 电解氯化铜溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的雾 | |
| C. | 碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| D. | 向含有苯酚的苯溶液中滴入少量浓溴水,产生了白色沉淀 |
1.下列有关晶体的说法正确的是( )
| A. | 分子晶体中分子间一定存在范德华力 | |
| B. | 晶格能越大,离子晶体的能量越高 | |
| C. | 离子键、共价键、金属键、氢键都是化学键 | |
| D. | 原子间通过共价键形成的晶体一定具有高熔点和高硬度. |