题目内容
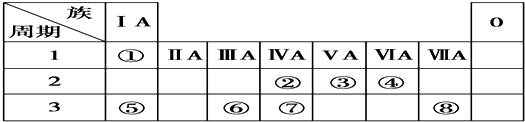
17.在第3周期中,化学性质最稳定的元素符号是Ar,最高价氧化物的水化物的酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是NaOH,显两性的氢氧化物的化学式是Al(OH)3,该元素两性氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH?=AlO2-+2H2O.分析 稀有气体原子最外层为稳定性结构,化学性质最不活泼;
同周期自左而右元素金属性减弱、非金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价氧化物对应水化物的酸性越强;氢氧化铝能与酸、碱反应生成盐与水,属于两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水.
解答 解:稀有气体Ar原子最外层为稳定性结构,化学性质最不活泼;
同周期自左而右元素金属性减弱、非金属性增强,故第三周期中Na金属性最强、Cl的非金属性最强,而金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价氧化物对应水化物的酸性越强,故NaOH碱性最强,HClO4的酸性最强,Al(OH)3能与酸、碱反应生成盐与水,属于两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH?=AlO2-+2H2O,
故答案为:Ar;HClO4;NaOH;Al(OH)3;Al(OH)3+OH?=AlO2-+2H2O.
点评 本题考查元素周期律的应用,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
20.对于mA(气)+nB(气)?pC(气)+qD(气)的平衡体系,当升高温度时,体系对氢气的相对密度从16.5变成16.9,则下列说法正确的是( )
| A. | m+n>p+q 正反应是放热反应 | B. | m+n>p+q 正反应是吸热反应 | ||
| C. | m+n<p+q 逆反应是放热反应 | D. | m+n=p+q 逆反应是吸热反应 |
5.将0.1mol•L-1的氨水加水稀释至0.01mol•L-1,稀释过程中温度不变,下列叙述正确的是( )
| A. | 稀释后溶液中的c(H+)和c(OH-)均减小 | |
| B. | 稀释过程中氨水的电离平衡向左移动 | |
| C. | 稀释后溶液中c(OH-)变为稀释前的$\frac{1}{10}$ | |
| D. | 稀释过程中溶液中$\frac{[0{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$增大 |
2.下列对Be及其化合物的叙述中,正确的是( )
| A. | Be的原子半径小于B 的原子半径 | |
| B. | Be比Na金属性强 | |
| C. | Be的最高价氧化物对应水化物碱性弱于Ca(OH)2 | |
| D. | Be能跟冷水反应产生氢气 |
6.元素周期律(表)是认识元素化合物性质的重要理论.
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.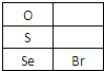
①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是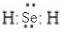 .
.
③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
(1)某学习小组研究了金属锂、钠、镁的性质后发现:
ⅰ.锂、镁和水反应均较为微弱,钠和水反应较为剧烈.
ⅱ.锂和镁的氢氧化物均为中等强度的碱.
ⅲ.锂、镁在空气中燃烧均生成氧化物,而钠在空气中燃烧生成过氧化物.
由以上事实,可知锂、钠、镁三种元素的金属性强弱关系是Na>Mg=Li.
(2)锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
①碱性:Sr(OH)2< Ba (OH)2(填“>”或“<”).
②用原子结构的观点解释锶的化学性质与钡差异的原因:锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱.
(3)硒(Se)的部分信息如右图,且知34Se、35Br位于同一周期.

①Se在元素周期表中的位置是第四周期第VIA族.
②H2Se的电子式是
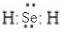 .
.③Cl、Se、Br的非金属性强弱的顺序是Cl>Br>Se.
能证明上述非金属性强弱关系的事实是氢化物的稳定性(写出一条即可).
④某同学对SeO2(白色的挥发性固体,易溶于水)的各种不同化学性质进行推测,并用SO2水溶液、H2O2溶液、NaOH溶液、稀H2SO4等试剂进行实验,证明了推测是正确的.
完成下表:
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O═Se+2H2SO4 |
| 2 | 还原性 | SeO2+2H2O2=H2SeO4+2H2O |
| 3 | 酸性氧化物 | SeO2+NaOH=Na2SeO3+H2O |
7.在进行牙科治疗之前,吸入笑气(N2O)能明显减轻牙科焦虑症.同温同压下,相同质量的下列气体与笑气体积相等的是( )
| A. | N2 | B. | CO | C. | CO2 | D. | NO2 |
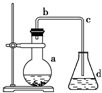 中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.
中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.