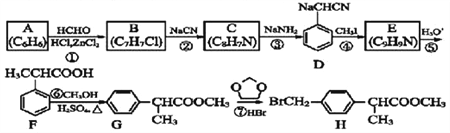
��Ŀ����
����Ŀ����.д�����з�Ӧ�缫����ʽ
��1��������Zn|ZnSO4��Һ||CuSO4|Cu��+��,������Ӧ��________
��2��������Pb|H2SO4��Ũ��|PbO2��+�� ������Ӧ��______________
��3��������H2��Pt��|KOH��Һ|��Pt��O2��+�� ������Ӧ��_____________
��.ij��ѧ��ȤС������ͼ��ʾװ�ý��е绯ѧԭ����ʵ��̽�����Իش��������⣺
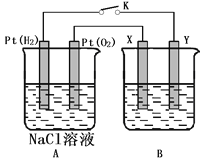
��1��ͨO2��Pt�缫Ϊ���_____________������缫���ƣ�����缫����ʽΪ_____________��
��2����B���Ϊ����ͭ���Ҵ�ͭ�к���Zn��Fe��Ag��Au�����ʣ���õ�����������Ҫ�ɷ���_______��
��3����X��Y����ͭ���������ҺΪNaOH��Һ����ع���һ��ʱ�䣬X����������ש��ɫ�������������ϵ�֪��Cu2O����д���õ缫�����ĵ缫��ӦʽΪ______________��
���𰸡� Zn��2 e��=Zn2+ PbO2+SO42��+2e��+4H+�TPbSO4+2H2O 2H2-4e-+4OH��=4H2O �� O2��4e����2H2O=4OH�� Ag��Au 2Cu��2OH����2e����Cu2O��H2O
�����������⿼�����ԭ��غ͵��صĹ���ԭ�����ص����ҳ�ԭ��ػ���ص�����������������Ӧ���ǻ�ԭ��Ӧ��ͬʱע��������Һ������ԡ�
(1)��п��ͭ��Ϊԭ��ص������缫ʱ��п�Ƚϻ��ã���������ʧȥ��������п���ӣ��缫��ӦΪ Zn��2e��=Zn2+ �� (2) Ǧ�Ͷ�����ǦΪ�����缫�ĵ���У�Ǧʧȥ���ӣ���������������Ǧ���������õ����ӣ������Һ�������������������Ǧ���缫��ӦΪPbO2+SO42��+2e��+4H+�TPbSO4+2H2O����3)�õ��Ϊ����ȼ�ϵ�أ���ҺΪ���ԣ����������ڸ�����Ӧʧȥ���ӽ����������������ˮ���缫��ӦΪ2H2-4e-+4OH��=4H2O��������������Ӧ�������������ӣ���.��1������Ϊ����ȼ�ϵ�أ�ͨ��������һ��Ϊ������ͨ��������һ��Ϊ��������ҺΪ�Ȼ��ƣ����������õ������������������ӣ��缫��ӦΪ��O2��4e����2H2O=4OH������2��BΪ��⾫��ͭ����XΪ�������缫����Ϊ��ͭ��YΪ������Ϊ��ͭ���ڵ������У���ͭ�е�п��ͭ������ʧȥ�����������ӣ������ͽ��ܷ�Ӧ��Ϊ��������֣���3��XΪ������ͭʧȥ���ӣ����������Ϣ��˵����������������ͭ����缫��ӦΪ��2Cu��2OH����2e����Cu2O��H2O��