题目内容
16.将9.0g铜和铁的混合物投入100ml稀硝酸中充分反应得到标况下1.12LNO,剩余4.8g金属,继续加入100ml等浓度的稀硝酸金属完全溶解,又得到标况下1.12LNO.若向反应后的溶液中滴入KSCN溶液不变红,则下列说法正确的是( )| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
分析 整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,再结合选项解答.
解答 解:整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、2323(x+y)=2.2422.42.2422.4,联立方程,解得:x=0.075mol、y=0.075mol,
A.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故A错误;
B.根据方程式可知,n(HNO3)=0.075mol×8383=0.2mol,稀硝酸的物质的量浓度为0.2mol0.1L0.2mol0.1L=2mol/L,故B错误;
C.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为0.075mol×130.075mol×13=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故C正确;
D.由上述分析可知,原混合物中铜和铁各0.075mol,故D错误;
故选C.
点评 本题考查混合物的有关计算,难度中等,利用整体法解答及判断最终的产物是关键,避免了过程法的繁琐,侧重对学生思维能力的考查.

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 一氯甲烷没有同分异构体 | B. | 甲烷分子的四个键完全不相同 | ||
| C. | 甲烷分子的四个键完全相同 | D. | 二氯甲烷没有同分异构体 |
 如图所示其反应原理可以表示为4K2CrO4+4H2O电解_电解––––– 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O电解_电解––––– 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )| A. | 随着反应进行,阴极PH逐渐减小 | |
| B. | OH-通过隔膜进入B池 | |
| C. | B池电极发生反应为2H2O+4e-4═H++O2↑ | |
| D. | 每转移2mol电子生成2g H2 |
| A. | 15.6% | B. | 25% | C. | 30% | D. | 无法确定 |
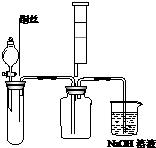 (1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.
(1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.