��Ŀ����
����Ŀ���ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ��������ʣ���������ͼ��ʾ�� 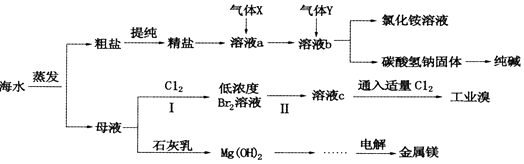
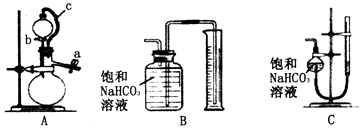
��1�����ú�ˮ���Ʊ�C12 �� Ϊ���ڴ��棬�ɽ�C12Һ����Ӧ��ȡ�Ĵ�ʩ֮һ�� ��
��2�������к��������ơ��Ȼ�þ���Ȼ��Ƶȿ��������ʣ�Ϊ��ȥ��Щ���ʶ��þ��Σ��������²��������ܽ� �ڼӹ�����BaCl2��Һ �ۼӹ�����NaOH��Һ �ܼӹ�����Na2CO3��Һ ������������ƣ���ͬ�� ������������ ��
��3������XΪ �� ��Һb�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��4������I���ѻ��Br2 �� ��������ֽ�Br2��ԭΪBr�� �� ��Ŀ��Ϊ �� �������ͨ���������Br2 �� ��SO2ˮ��Һ�������գ��õ���Һc����Ӧ�����ӷ���ʽΪ �� ��ʵ�����У��ӹ�ҵ������ȡ�嵥�ʵ�ʵ����������� ��
��5����ҵ����ȡ����þ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1������ �����ѹ��
��2�����ˣ������ᾧ
��3��NH3��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl
��4��������Ԫ�أ�Br2+SO2+2H2O�T4H++SO42��+2Br������ȡ
��5��MgCl2�����ڣ� ![]() Cl2��+Mg
Cl2��+Mg
���������⣺��1�������£�����Ϊ���壬���� �����ѹ����Һ����ת��ΪҺ���������ʹ��棬���Դ��ǣ����� �����ѹ������2�������ɵ����ᱵ��̼�ᱵ��̼��ơ�������þ��������Һ�г�ȥ�ù��˵ķ������Ȼ��ƺ�����Ļ����Һ�õ��Ȼ��ƾ��壬�����������ᾧ�ķ�������ȥ��Һ�е��Ȼ����ˮ�����Դ��ǣ����ˣ������ᾧ����3����ͬ�����£��������ܽ�ȴ��ڶ�����̼��Ϊ����߶�����̼���ܽ�ȣ�����ʳ��ˮ��ͨ�백����������Һb��Ϊ�Ȼ��ƺͰ�ˮ�Ļ��Һ������XΪ������YΪ������̼��NaCl��NH3��CO2�ȷ�����Ӧ����NaHCO3��NH4Cl����ӦΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
���Դ��ǣ�NH3��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����4����������ѻ������̬����Ũ�Ⱥܵͣ����ֱ�����������ɱ��ϸߣ������ڹ�ҵ��������������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ���Ǹ�����Ԫ�أ����ͳɱ����������������嵥�ʷ�����Ӧ������ǿ��HBr��H2SO4 �� ���ӷ�ӦΪ��Br2+SO2+2H2O�T4H++SO42��+2Br�� �� �����л��ܼ��е��ܽ�ȴ�����ˮ�е��ܽ�ȣ����л��ܼ���ˮ�����ܣ����Կ��Բ�����ȡ�ķ�����ȡ�壬
���Դ��ǣ�������Ԫ�أ�Br2+SO2+2H2O�T4H++SO42��+2Br������ȡ����5��������״̬�µ���Ȼ�þұ��þ����ⷴӦ����ʽΪ��MgCl2�����ڣ� ![]() Cl2��+Mg��
Cl2��+Mg��
���Դ��ǣ�MgCl2�����ڣ� ![]() Cl2��+Mg��
Cl2��+Mg��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�