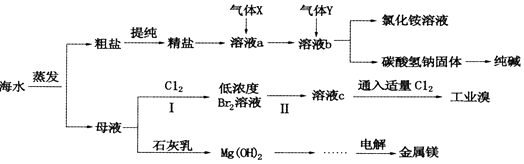
��Ŀ����
����Ŀ��������ij��ȤС����ݿα�ʵ����Ƶ�һ����˵��̼������̼���������ȶ��Ե���ʵ������ΪС�մ���Ϊ��������۲���ͼ��ʵ��װ�á�����ʵ��ԭ��������˵����������� ��

A. ���ձ��е�ʯ��ˮ�ȱ���ǣ�����ʯ��ˮ���������
B. Ҫ֤��̼�����������ܲ���ˮ������С�Թ�������մ����ˮ����ͭ��ĩ������
C. ����ʵ������п��Կ������ձ��ij���ʯ��ˮû�����
D. ͨ����ʵ��ɶԱ�С�մ�ʹ�������ȶ���
���𰸡�A
��������A.̼�����Ʋ��ȶ������ȷֽ����ɶ�����̼���壬���Զ��ձ��е�ʯ��ˮ�ȱ������̼���ƽ��ȶ������ȹ����в���ֽ⣬�����ӱ��ձ����Թܲ������������̼�����Ա��ձ��ij���ʯ��ˮ������ǣ���A����B.��ɫ����ˮ����ͭ����ˮ��ʾ��ɫ����֤��̼�����������ܲ���ˮ������С�Թ�������մ����ˮ����ͭ��ĩ���������������˵����ˮ���ɣ���B��ȷ��C��̼���ƽ��ȶ������ȹ����в���ֽ⣬�����ӱ��ձ����Թܲ������������̼�����Ա��ձ��ij���ʯ��ˮ������ǣ���C��ȷ�� D.̼��������С�Թܣ�̼�����ڴ�ʹ�ܣ����Թ�ֱ�Ӽ��ȣ��¶Ƚϸߣ����¶ȽϸߵIJ��ֽ⣬�������¶Ƚϵ͵����ʷֽ⣬���ж��ȶ�ǿ������D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��T��ʱ����2L�����ܱ���������̬����X��Y��Z�����ʵ�����ʱ��仯�IJ������������ʾ��
T/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ
��2����Ӧ���е�10min��X��ת����Ϊ �� 0��5min��Y��ƽ����Ӧ����Ϊ
��3������T��ʱ�÷�Ӧ��ƽ�ⳣ��K=
��4��T��������ܱ�������ͨ��һ������X��Y��Z����Ӧ��ijʱ�̲��X��Y��Z�����ʵ����ֱ�Ϊ1.00mol��0.50mol��1.60mol�����ʱ���淴Ӧ���ʴ�С��v��v��������ڡ��������ڡ�����С�ڡ���
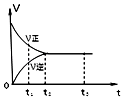
��5������10min��t3��t5ʱ�̷ֱ�ı�÷�Ӧ��ijһ��Ӧ�������õ�X��Z�����ʵ�������Ӧ������ʱ��Ĺ�ϵ��ͼA��B��ʾ�� 
��10minʱ�ı�ķ�Ӧ������
��t3ʱ�̸ı�ķ�Ӧ������t5ʱ�̸ı�ķ�Ӧ������ �� ������ ��