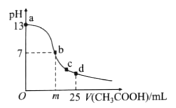
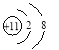题目内容
【题目】(某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
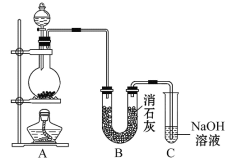
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目________,并指出氧化剂为___________,还原剂为________。
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目________,并指出氧化剂为___________,还原剂为________。
(2)漂白粉将在U形管中产生,其化学方程式是________________________________。
(3)C装置的作用是___________________。
(4)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可将采取的措施是_________________________________________。
②试判断另一个副反应(用化学方程式表示)___________________________________________;为避免此副反应的发生,可将装置作何改进____________________________________。
【答案】![]() MnO2 HCl 2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O 吸收未完全反应的氯气,防止污染空气 B装置冷却(或将B装置放在冷水浴中) 2HCl+ Ca(OH)2=2H2O+ CaCl2 在A、B之间接一个饱和的NaCl溶液洗气瓶
MnO2 HCl 2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O 吸收未完全反应的氯气,防止污染空气 B装置冷却(或将B装置放在冷水浴中) 2HCl+ Ca(OH)2=2H2O+ CaCl2 在A、B之间接一个饱和的NaCl溶液洗气瓶
【解析】
(1)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素得到2个电子,化合价由+4价下降到+2价;Cl元素失去2个电子,化合价由-1价上升到0价;
MnCl2+Cl2↑+2H2O中Mn元素得到2个电子,化合价由+4价下降到+2价;Cl元素失去2个电子,化合价由-1价上升到0价;
(2)因氯气与消石灰反应生成氯化钙、次氯酸钙和水;
(3) 因氯气有毒,则装置C的作用为吸收未完全反应的氯气,防止污染空气;
(4)温度较高时发生副反应生成Ca(ClO3)2,则可将B装置冷却来避免该副反应的发生,另一个副反应为HCl与消石灰反应,所以应除去氯气中的HCl。
(1)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素得到2个电子,化合价由+4价下降到+2价;Cl元素失去2个电子,化合价由-1价上升到0价,在方程式中标出电子转移方向和数目为:
MnCl2+Cl2↑+2H2O中Mn元素得到2个电子,化合价由+4价下降到+2价;Cl元素失去2个电子,化合价由-1价上升到0价,在方程式中标出电子转移方向和数目为:![]() ;氧化剂是MnO2,还原剂是HCl;
;氧化剂是MnO2,还原剂是HCl;
(2)因氯气与消石灰反应生成氯化钙、次氯酸钙和水,化学反应方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3) 因氯气有毒,则装置C的作用为吸收未完全反应的氯气,防止污染空气,故答案为:吸收未完全反应的氯气,防止污染空气;
(4)①因温度较高时发生副反应生成Ca(ClO3)2,则可将B装置冷却来避免该副反应的发生,故答案为:将B装置冷却(或将B装置放在冷水浴中);
②因浓盐酸易挥发,则另一个副反应为HCl与消石灰反应,方程式为:2HCl+ Ca(OH)2=2H2O+ CaCl2,所以应除去氯气中的HCl,即在A、B之间接一个饱和的NaCl溶液洗气瓶可除去HCl,故答案为:2HCl+ Ca(OH)2=2H2O+ CaCl2;在A、B之间接一个饱和的NaCl溶液洗气瓶。

【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | H | |||||||
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | S | Cl |
(1)金属性最强的元素是______(填元素符号)。
(2)最不活泼元素的原子结构示意图为________。
(3)第3周期元素中,其最高价氧化物对应得水化物具有两性得元素是______(填元素名称)。
(4)Na、Mg两种元素中,原子半径较大的是______。
(5)第3周期中,某元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为_______。
(6)工业上可以用Cl2和H2来制取盐酸该反应的方程式为_______________________________。
(7)HF与HCl热稳定性较强的是_________。
(8)由碳与氢元素形成的最简单有机物的化学式为_____,该物质中碳元素与氢元素的质量比为_________,其分子空间构型为_____________。
(9)重氢![]() 和超重氢
和超重氢![]() 两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
【题目】短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
| 1.00 | 13.00 | 1.57 | 0.70 |
A.元素电负性:Z<WB.简单离子半径:W<Y
C.元素第一电离能:Z<WD.简单氢化物的沸点:X<Z