题目内容
【题目】依据元素周期表和周期律的相关知识,下列说法正确的是( )
A.短周期元素中,原子最外层只有一个或两个电子的元素一定是金属元素
B.I属于副族元素
C.H2S的稳定性比H2O的稳定性强
D.Na、Mg、Al与冷水反应速率逐渐减弱
【答案】D
【解析】
A.He元素最外层电子数为2,是非金属元素,A错误;
B.I属于第ⅦA族,是主族元素,B错误;
C.同一主族元素从上到下非金属性依次减弱,所以非金属性O>S,非金属性越强,氢化物的稳定性越强,故H2S的稳定性比H2O的稳定性弱,C错误;
D.同周期元素从左到右金属性依次减弱,故金属性Na>Mg>Al,金属性越强,与酸或水反应越剧烈,D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】某实验科研小组研制了一种从废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
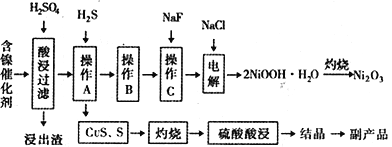
回答下列问题:
(1)浸出渣主要成分为CaSO4↓·2H2O和_______________两种物质。
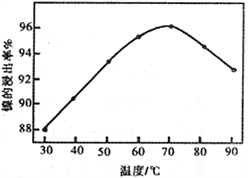
(2)右图表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是_____________________________。
(3)工艺流程中的“副产品”为________(填化学式)。
(4)已知有关氢氧化物开始沉淀和沉淀完全的pH 如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: ___________________________________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =________________。(常温时,Ksp(CaF2)=2.7×10-11)
=________________。(常温时,Ksp(CaF2)=2.7×10-11)
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO-,消耗OH-______________mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为_________________________。