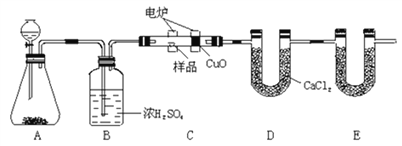
题目内容
【题目】可用于分离或提纯物质的方法有:过滤、蒸发结晶、蒸馏、萃取、分液、洗气。根据需求填下列装置的序号并填上操作名称:
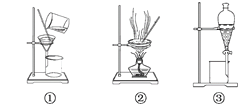
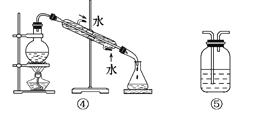
(1)分离Na2CO3溶液和CCl4,选_____,操作名称为________。
(2)用CCl4提取碘水中的碘,选______,操作名称为________。
(3)用氢氧化钠溶液吸收O2中混有的杂质Cl2,选_______,操作名称为________。
(4)除去澄清石灰水中悬浮的CaCO3颗粒选______,操作名称为__________。
(5)制取蒸馏水,选________,操作名称为________。
【答案】③ 分液 ③ 萃取(分液) ⑤ 洗气 ① 过滤 ④ 蒸馏
【解析】
(1)Na2CO3溶液和CCl4互不相溶;
(2)用CCl4提取碘水中的碘,水与四氯化碳互不相溶,分层,碘在四氯化碳中溶解度大;
(3)氯气可用氢氧化钠溶液除杂;
(4)CaCO3是不溶于水的物质;
(4)水的沸点不高;
(1)Na2CO3溶液和CCl4互不相溶,可用分液的方法分离;选③,操作名称为分液;
(2)用CCl4提取碘水中的碘,水与四氯化碳互不相溶,分层,碘在四氯化碳中溶解度大,可用萃取的方法分离;选③,操作名称为萃取(分液);
(3)氯气可用氢氧化钠溶液洗气,达到除杂的目的,选 ⑤,操作名称为洗气;
(4)根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法;选①,操作名称为过滤;
(4)水的沸点不高,可选用蒸馏的方法制取;选④,操作名称为蒸馏。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
①流程中先加双氧水的目的是__________________________________________。
②加氨水调节溶液的pH等于6,则滤渣的成分是__________________,滤液中含有的阳离子有H+ 和___________________。
(3)在浸出液里锰元素只以Mn2+ 的形式存在,且滤渣中也无MnO2,请解释原因_________。
(4)阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,则A电极是______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__________________________。

(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________________________________。