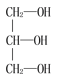
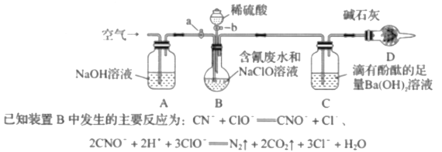
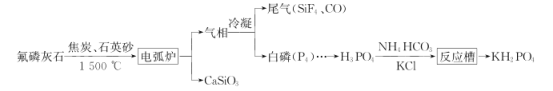
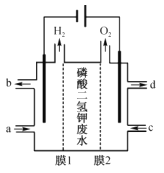
题目内容
【题目】下表是稀硫酸与某金属反应的实验数据:
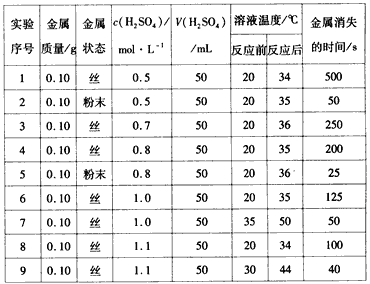
分析上述数据,完成下列问题:
(1)实验4和5表明____________对反应速率有影响,________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:____
【答案】固体反应物的表面积 表面积越大 1、2 1、3、4、6、8或2、5 反应温度 6、7或8、9 因为所有反应中,金属的质量和硫酸溶液体积均相等,并且硫酸过量,产生的热量相等,所以溶液的温度变化值相近
【解析】
(1)根据表格数据,实验4和5中金属和稀硫酸的量相同,金属的状态不同;
(2)必须满足除了浓度以外,其他条件完全相同的实验;
(3)6和7或8和9中探究了温度对反应速率的影响;
(4)根据反应中金属的质量和硫酸溶液的体积分析解答。
(1)实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,能表明同一规律的实验还有1和2,故答案为:固体反应物的表面积;表面积越大;1和2;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,起始温度也应该相同,符合条件的实验有1、3、4、6、8或2、5,故答案为:1、3、4、6、8或2、5;
(3)本实验中,反应温度也影响化学反应速率,如实验6、7或8、9,故答案为:反应温度;6、7或8、9;
(4)所有反应中,金属的质量和硫酸溶液的体积均相等,且硫酸过量,产生热量相等,所以实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,故答案为:所有反应中,金属的质量和硫酸溶液体积均相等,且硫酸过量,产生的热量相等,所以溶液温度变化值相近。

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大