题目内容
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称________,可作为碱使用的原因是___________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1
②NaOH(s)+CO2(g)= NaHCO3(s) ΔH1=131.5 kJ·mol1
反应2NaHCO3 (s)= Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol1,该反应的平衡常数表达式K=________。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
(4)已知室温时,Ksp[Mg(OH)2]=4.0×1011。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3) 。
【答案】 纯碱或苏打 CO32-+H2OHCO3-+OH- +135.6 c(H2O)﹒c(CO2) 23.6 11.3
【解析】(1)碳酸钠俗称纯碱或苏打;Na2CO3为强碱弱酸盐,CO32-离子水解方程式为CO32-+H2OHCO3-+OH-,使溶液呈碱性,故答案为:纯碱或苏打;CO32-+H2OHCO3-+OH-;
(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=-127.4kJmol-1,②NaOH(s)+CO2(g)═NaHCO3(s)△H1=-131.5kJmol-1,①-2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)△H=+135.6kJmol-1;K=c(H2O)c(CO2),故答案为:+135.6;c(H2O)c(CO2);
(3)Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.1×10-10;Ksp(BaCO3)=c(Ba2+)c(CO32-)=2.6×10-9,所以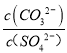 =
=![]() =
=![]() =
=![]() =23.6,故答案为:23.6;
=23.6,故答案为:23.6;
(4)已知c(MgCl2)=0.1molL-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,c(Mg2+)=10-5 mol/L,即Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),故c(OH-)=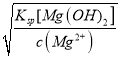 =
=![]() =2×10-3,Kw=1.0×10-14,故c(H+)=
=2×10-3,Kw=1.0×10-14,故c(H+)=![]() =
=![]() ×10-11,pH=11.3,故答案为:11.3。
×10-11,pH=11.3,故答案为:11.3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案