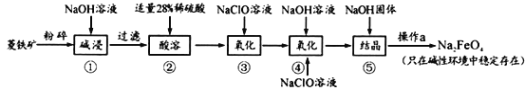
题目内容
【题目】按要求回答下列问题:
(1) 一定温度下,发生反应: 2 SO2(g)+ O2 (g)![]() 2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:
2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:

①0~2 min内,v(SO2)=_______________
②达到平衡时SO3的物质的量浓度为____________
③下列可证明上述反应达到平衡状态的是____________(填序号)。
a. v(O2)=2v(SO3)
b. O2的物质的量浓度不再变化
c.每消耗1molO2,同时生成2molSO3
d.容器内压强保持不变
(2)已知可逆反应: 2NO2(g) (红棕色) ![]() N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
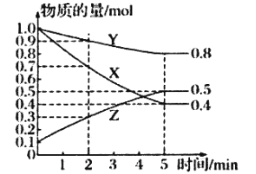
(3)某温度下的密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图,则该反应的化学方程式为_________________
【答案】0.4mol·L-1·min-1 1.0mol·L-1 bd 红棕色颜色加深 该反应为放热反应,升高温度平衡逆向移动,使NO2浓度增大,颜色加深 3X(g)+Y(g)![]() 2Z(g)
2Z(g)
【解析】
(1)①0~2 min内,△n(O2)=2.0mol-1.2mol=0.8mol,根据反应方程式可知该时间段内△n(SO2)=1.6mol,容器体积为2L,所以v(SO2)=![]() = 0.4mol·L-1·min-1;
= 0.4mol·L-1·min-1;
②根据表格数据可知4min后氧气的物质的量不再改变,说明反应达到平衡,平衡时△n(O2)=2.0mol-1.0mol=1.0mol,根据反应方程式可知△n(SO3)=2.0mol,容器体积为2L,所以平衡时c(SO3)=1.0mol·L-1;
③a.反应达到平衡时正逆反应速率相等,但选项并未标注是正反应速率还是逆反应速率,而且同一方向的不同物质的反应速率之比等于计量数之比,所以无论是正反应速率还是逆反应速率都不可能出现v(O2)=2v(SO3),故a不符合题意;
b.反应达到平衡时正逆反应速率相等,各物质的浓度不再改变,所以氧气的物质的量浓度不再改变能说明反应平衡,故b符合题意;
c.消耗O2和生成SO3均为正反应,只有反应进行,无论是否平衡都存在每消耗1molO2,同时生成2molSO3,故c不符合题意;
d.该反应前后气体系数之和不相等,所以未平衡时气体的总物质的量会变,容器的体积不变,所以压强会变,当压强不变时说明反应平衡,故d符合题意;
综上所述选bd;
(2)放入热水中温度升高,该反应正反应为放热反应,所以升高温度平衡逆向移动,使NO2浓度增大,颜色加深,所以可以观察到红棕色颜色加深;
(3)据图可知X、Y的物质的量减小,Z的物质的量增加,所以X、Y为反应物,Z为生成物,相同时间内△n(X):△n(Y):△n(Z)=(1.0-0.4)mol:(1.0-0.8)mol:(0.5-0.1)mol=3:1:2,所以反应方程式为3X(g)+Y(g)![]() 2Z(g)。
2Z(g)。

【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
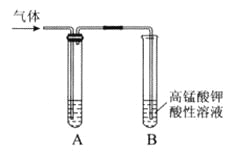
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________。 | NaOH溶液 |
③ | 乙炔 | 电石与饱和食盐水反应 | _________ |
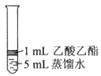
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是_____________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________。