题目内容
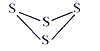
【题目】Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____kJ。
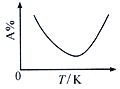
Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)![]() 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为_________(已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______点。
III. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
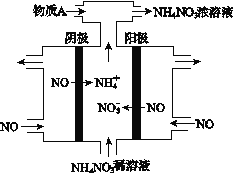
①阴极的电极反应式为_________________________。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________。
【答案】243 < 0.0025mol·L-1·min-1 加入催化剂 -2.6 C、D 6H++NO+5e-=NH4++H2O NH3
【解析】
(1)反应热△H=反应物键能总和-生成物键能总和;
(2) ①根据该反应中某一反应物的体积分数(以A%表示)随温度的变化关系图可知,当反应达到平衡(A%最低)时,继续升温A%又升高,说明升温平衡向逆方向移动,故△H<0。
②根据三步骤法进行计算;
③根据数据Ⅱ特点,反应达到平衡需要的时间比数据Ⅰ快,而反应达到平衡时的温度与起始温度相同,唯一能改变的就是使用催化剂。
(3)①373K时,反应的平衡常数K=![]() =400;
=400;
②该反应为放热反应,升高温度平衡向你反应方向移动,K减小,变化点为C、D;
(4)电解NO制备NH4NO3,,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3由此可以解答。
3NH4NO3+2HNO3由此可以解答。
(1)根据反应热△H=反应物键能总和-生成物键能总和,4×266 kJ·mol-1+4E(Cl—Cl)-8×255 kJ·mol-1= - 4 kJ·mol-1,求得E(Cl—Cl)= 243.
(2) ①根据该反应中某一反应物的体积分数(以A%表示)随温度的变化关系图可知,当反应达到平衡(A%最低)时,继续升温A%又升高,说明升温平衡向逆方向移动,故△H<0。
②根据三步骤法进行计算:
SO2(g) + SCl2(g) + Cl2(g) ![]() 2SOCl2(g)
2SOCl2(g)
起始(mol·L-1) 0.02 0.02 0.02 0
转化(mol·L-1) x x x 2x
平衡(mol·L-1) 0.02-x 0.02-x 0.02-x 2x
根据阿伏加德罗定律:![]() ,则有
,则有![]() ,解得x=0.01 mol·L-1,v(SCl2)=
,解得x=0.01 mol·L-1,v(SCl2)= ![]() =0.0025 mol·L-1·min-1;
=0.0025 mol·L-1·min-1;
③根据数据Ⅱ特点,反应达到平衡需要的时间比数据Ⅰ快,而反应达到平衡时的温度与起始温度相同,唯一能改变的就是使用催化剂。
(3)①373K时,反应的平衡常数K=![]() =400,故A点数值为pK=-lg400=-2.6;
=400,故A点数值为pK=-lg400=-2.6;
②该反应为放热反应,升高温度平衡向你反应方向移动,K减小,变化点为C、D;
(4)电解NO制备NH4NO3,,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。