题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.含有大量Al3+的溶液: Na+、SO![]() 、Cl-、NO
、Cl-、NO![]()
B.使酚酞变红色的溶液:Na+、Ca2+、CO![]() 、K+
、K+
C.0.1mol·L-1FeCl3溶液: K+、Na+、Br-、SCN-
D.0.1mol·L-1NaHCO3溶液: Na+、H+、NO![]() 、SO
、SO![]()
【答案】A
【解析】
A.含有大量Al3+的溶液: Na+、SO![]() 、Cl-、NO
、Cl-、NO![]() ,各离子之间相互不反应,故可以大量共存,A符合题意;
,各离子之间相互不反应,故可以大量共存,A符合题意;
B.由于Ca2++CO![]() =CaCO3↓,Ca2+与CO
=CaCO3↓,Ca2+与CO![]() 不能大量共存,B不合题意;
不能大量共存,B不合题意;
C.由于Fe3++SCN-=Fe(SCN)2+络离子,故Fe3+与SCN-不能大量共存,C不合题意;
D. ![]() + H+=H2O+CO2↑,故
+ H+=H2O+CO2↑,故![]() 和 H+不能大量共存,D不合题意;
和 H+不能大量共存,D不合题意;
故答案为:A。

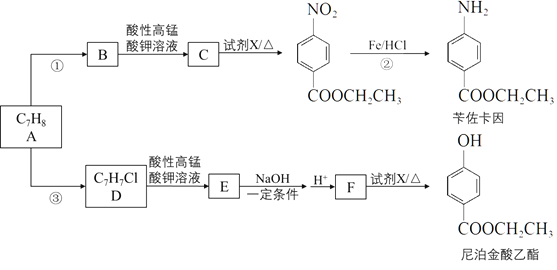
【题目】Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____kJ。
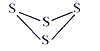
Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)![]() 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为_________(已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______点。
III. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
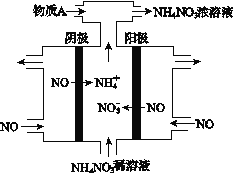
①阴极的电极反应式为_________________________。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________。